A Consensus Molecular Classification of Muscle-invasive Bladder Cancer опубликован EAU в апреле текущего года. Как отмечают сами авторы консенсуса, этот документ наконец объединил в себе все ранее предложенные классификации, которые отличались значительной разнородностью. Предлагается использовать эту классификацию для персонализации лечения рака мочевого пузыря.
Свести воедино
Сегодня в лечении мышечно-инвазивного рака мочевого пузыря активно применяются различные подходы лекарственного лечения – неоадъювантная химиотерапия, таргетная терапия, иммунотерапия. На молекулярном уровне это заболевание является достаточно гетерогенным, что на протяжении долгого времени побуждало создавать системы по стратификации пациентов в зависимости от прогноза и чувствительности к лечению.
Ранее было опубликовано множество молекулярных классификаций рака мочевого пузыря, однако их немалое количество, и отсутствие единого консенсуса затрудняло внедрение этих знаний в клиническую практику. К тому же предложенные классификации имеют разное количество подтипов с разными названиями, что делало практически невозможным сопоставление этих систем.
Коллективом экспертов EAU были проанализированы транскриптомные профили из 18 баз данных по 1750 больным мышечно-инвазивным раком мочевого пузыря. Результаты анализа представлены в журнале European Urology (Kamoun et al., 2020). Используя критерии по определению подтипов в каждой из шести существующих классификаций, авторы исследования на первом этапе присвоили каждому пациенту тот или иной подтип по каждой из классификаций, после чего с помощью специального программного обеспечения определялись пациенты, схожие по характеристикам разных систем, и сводились в единый молекулярный подтип. При определении названий молекулярных подтипов учитывалось, чтобы такой подтип уже существовал минимум в трех из существующих шести классификаций.
Результат анализа – определены 6 молекулярных вариантов мышечно-инвазивного рака: люминальный папиллярный, люминальный неспецифический, люминальный нестабильный, стромальный, базальный/плоскоклеточный и нейроэндокринно-подобный (рис. 1).
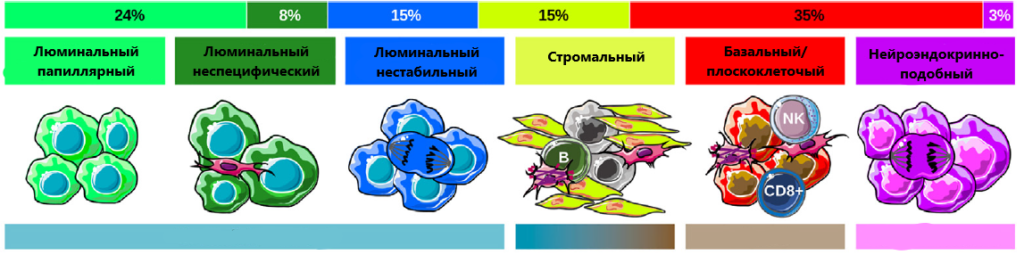
Каждый подтип характеризуется определенной дифференцировкой, механизмами канцерогенеза, опухолевым микроокружением и особенностями клинического течения. Особенности каждого подтипа представлены в таблице.
| Люминальный папиллярный | Люминальный неспецифический | Люминальный нестабильный | Стромальный | Базальный/ плоскоклеточный | Нейроэндокринно- подобный | |
| Особенности канцерогенеза | FGFR3+ PPARG+ CDKN2A- | PPARG+, | PPARG+, ERBB2+, геномная нестабильность, повышенная активность клеточного цикла | EGFR+ | TP53-, RB-, повышенная активность клеточного цикла | |
| Частые мутации | FGFR3 (40%), KDM6A (38%) | ELF3 (35%) | TP53 (76%), ERCC2 (22%), TMB+ | TP53 (61%), RB1 (25%) | TP53 (94%), RB1 (39%). | |
| Инфильтрация стромальными клетками | Фибробласты | Гладкомышечные клетки, фибробласты, миофибробласты | Фибробласты, миофибробласты | |||
| Инфильтрация иммунными клетками | В-лимфоциты | NK-клетки CD8+ Т-лимфоциты | ||||
| Клинические особенности | Превалирует среди стадии T2 | Пожилые пациенты (80+) | Чаще у женщин, превалируют стадии T3/T4 | |||
| Медиана общей выживаемости (годы) | 4 | 1,8 | 2,9 | 3,8 | 1,2 | 1 |
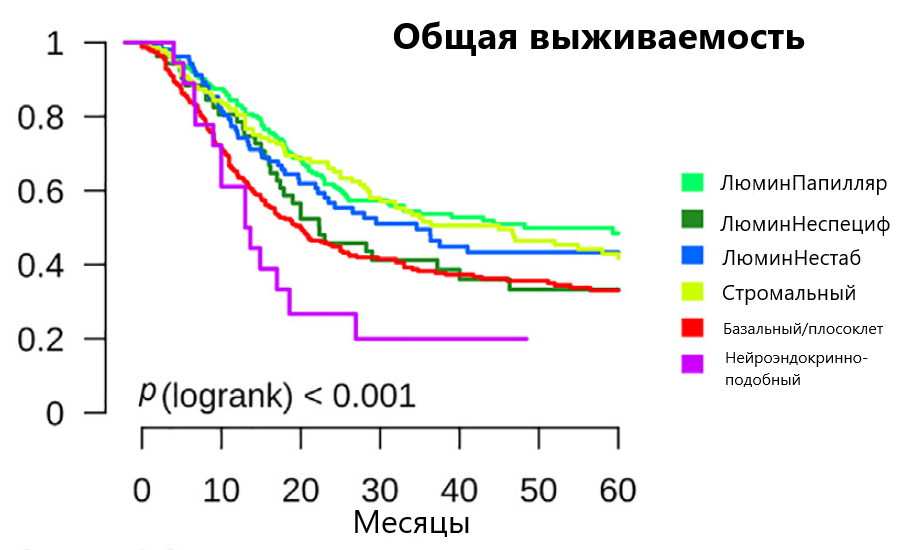
При сравнении выживаемости между подгруппами больных было выявлено, что наиболее благоприятным является люминальный папиллярный тип, в то время как наихудшим прогнозом обладают пациенты с нейроэндокринно-подобным подтипом рака мочевого пузыря (рис. 2).
Терапевтическое применение
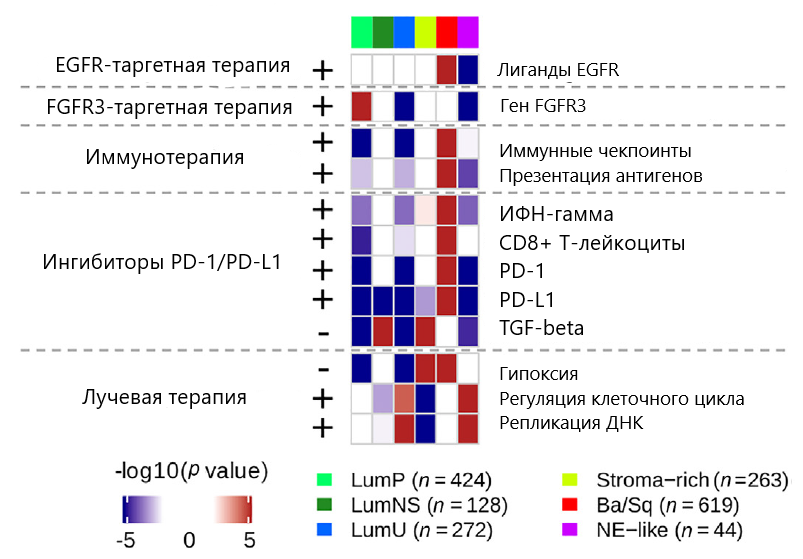
В предложенной классификации наиболее важным представляется ее прикладной аспект, указывающий на различия в прогнозе заболевания и чувствительности к разным вариантам лекарственного лечения. В результате проведенного анализа консенсус EAU предлагает возможные терапевтические опции при различных вариантах опухоли. Так, к примеру, высокая частота мутаций гена FGFR3 при люминальном папиллярном типе опухоли, а также наличие признаков активации гена FGFR3 позволяют предполагать, что такие опухоли могут быть чувствительны к ингибиторам FGFR даже вне зависимости от мутационного статуса. В проведенных ранее исследованиях было показано, что применение ингибиторов FGFR позволяет достичь клинического эффекта в 40 % случаев в случае мутации или транслокации гена FGFR3 (Pal et al., 2018; Loriot et al., 2019). Также в исследованиях III фазы у больных мышечно-инвазивным раком мочевого пузыря была показана эффективность применения ингибиторов VEGFR2 (Petrylak et al., 2017).
Базальный/плоскоклеточный тип опухолей имеет высокий уровень экспрессии гена EGFR, что может говорить о чувствительности к EGFR-таргетной терапии (рис. 3). Помимо этого опухоли данного подтипа активно экспрессируют маркеры-мишени для чекпоинт-ингибиторов, такие как PD-1 и PD-L1, а также отличаются обильной инфильтрацией CD8+ Т-лейкоцитами и высокой антигенной нагрузкой, что указывает на их чувствительность к иммунотерапии.
Также в результате анализа определено, что опухоли нейроэндокринно-подобного и люминального нестабильного подтипов имеют склонность к чувствительности к лучевой терапии, о чем говорит повышенная активность клеточного цикла и низкая склонность к гипоксии. Более того, авторами консенсусной классификации был проведен ретроспективный анализ результатов лечения, получивших или не получивших неоадъювантную химиотерапию. Было выявлено, что у пациентов с базальным/плоскоклеточным и люминальным неспецифическим подтипом отмечен более выраженный эффект на лечение, а наименьший ответ на терапию имели пациенты со стромальным вариантом опухоли.
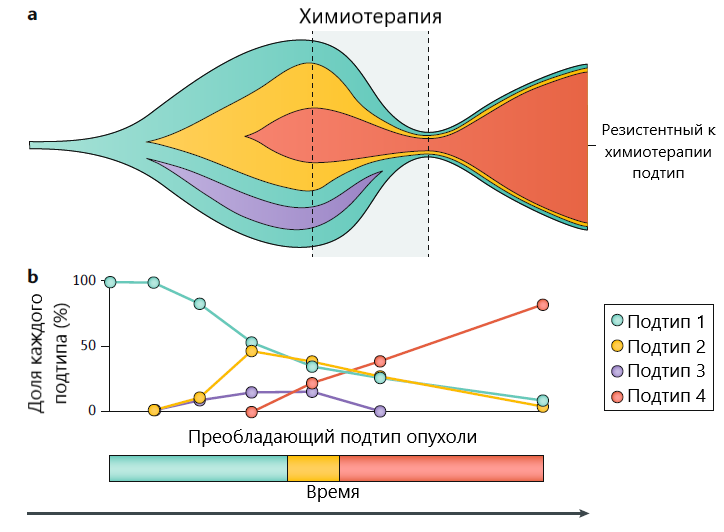
Опухолевая гетерогенность
Рак мочевого пузыря является опухолью с высокой мутационной нагрузкой, имея в среднем более 7 мутаций на один опухолевой образец – больше только при раке легкого и раке кожи. Считается, что такая мутационная нагрузка способствует развитию опухолевой гетерогенности. Опухолевая гетерогенность, особенно внутриопухолевая гетерогенность, является одной из важнейших причин развития резистентности к системной терапии (рис. 4).
Некоторые специалисты отмечают, что наличие внутриопухолевой гетерогенности является одним из слабых мест в клиническим применении молекулярных классификаций (Meeks et al., 2020). Высокая частота мутаций в опухоли и наличие внутриопухолевой гетерогенности позволяют предположить, что различия в генетическом профиле возникают в опухоли с течением времени. Метастатические очаги могут быть представлены другими клонами опухолевых клеток, а это значит, что в случае с конкретным пациентом могут быть оправданными повторные генотипирования опухолевых очагов для продолжения персонализированной терапии.
Как уже было сказано ранее, различные гистологические варианты мышечно-инвазивного рака мочевого пузыря (например, микропапиллярный вариант) имеют различный генетический профиль (например, гиперэкспрессию гена ERBB2), однако в реальной практике пока не ясно, действительно ли это коррелирует с чувствительностью на определенные группы препаратов (например, Her2-таргетную терапию). Но на этот вопрос можно будет ответить только по результатам исследований, в которых будет оценена чувствительность к тому или иному виду системной терапии с учетом предложенной молекулярной классификации.
Заключение
Наше современное понимание механизмов прогрессирования рака мочевого пузыря позволяет понять, что однотипное лечение для всех пациентов вряд ли может принести максимально возможный эффект, принимая во внимание внутри- и межопухолевую гетерогенность. Описанная консенсусная классификация EAU позволит в дальнейшем использовать унифицированный подход в изучении принципов персонализированного лечения.
Список литературы:
- Kamoun, A. et al. (2020) ‘A Consensus Molecular Classification of Muscle-invasive Bladder Cancer[Formula presented]’, European Urology. doi: 10.1016/j.eururo.2019.09.006.
- Loriot, Y. et al. (2019) ‘Erdafitinib in locally advanced or metastatic urothelial carcinoma’, New England Journal of Medicine. doi: 10.1056/NEJMoa1817323.
- Meeks, J. J. et al. (2020) ‘Genomic heterogeneity in bladder cancer: challenges and possible solutions to improve outcomes’, Nature Reviews Urology. doi: 10.1038/s41585-020-0304-1.
- Pal, S. K. et al. (2018) ‘Efficacy of BGJ398, a fibroblast growth factor receptor 1–3 inhibitor, in patients with previously treated advanced urothelial carcinoma with FGFR3 alterations’, Cancer Discovery. doi: 10.1158/2159-8290.CD-18-0229.
- Petrylak, D. et al. (2017) ‘Ramucirumab plus docetaxel versus placebo plus docetaxel in patients with locally advanced or metastatic urothelial carcinoma after platinum-based therapy (RANGE): a randomised, double-blind, phase 3 trial’, The Lancet. doi: 10.1016/S0140-6736(17)32365-6.
21.10.2020



