ᅠ ᅠ
Скачать в PDF ⟶
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:
C67
Возрастная категория:
Взрослые
Год утверждения:
2020
Год окончания действия:⠀
2022
Статус
Архивная
Рабочая группа:
Блок по организации медицинской помощи:
Конфликта интересов нет.
Разработчик клинической рекомендации:
Список сокращений
Термины и определения
БЦЖ – бацилла Кальметта–Герена
в/в – внутривенно
ВМП – верхние мочевыводящие пути
ВОЗ – Всемирная организация здравоохранения
ИМП – инфекция мочевых путей
КТ – компьютерная томография
ЛТ – лучевая терапия
ЛУ – лимфатический узел
ЛФК – лечебная физическая культура
МИ РМП – мышечно-инвазивный рак мочевого пузыря
МКА – моноклональные антитела (код АТХ-классификации: L01XС)
МКБ-10 – международная классификация болезней 10-го пересмотра
МП – мочевой пузырь
МРТ – магнитно-резонансная томография
НМИ РМП – немышечно-инвазивный рак мочевого пузыря
ПСА – простат-специфический антиген
ПХТ – полихимиотерапия
РМП – рак мочевого пузыря
РКИ – рандомизированное контролируемое исследование
США – Соединенные Штаты Америки
ТУР – трансуретральная резекция мочевого пузыря
УД – уровень доказательности
УЗИ – ультразвуковое исследование
ФД – флюоресцентная диагностика
ХТ – химиотерапия
ЦИ – цитологическое исследование
ЦЭ – цистэктомия
AUC – areaundercurve – площадь под фармакологической кривой, расчет дозы карбоплатина по площади под фармакологической кривой производится по формуле Calvert (1989): доза карбоплатина= AUC х (клиренс креатинина+25).
BTA – bladdertumorantigen (антиген рака мочевого пузыря)
CIS – карцинома insitu
PUNLMP – papillaryurothelialneoplasm of lowmalignant (папиллярная неоплазияуротелияс низким злокачественным потенциалом)
RECIST – response evaluation criteria in solid tumours (критерииответасолидныхопухолейнатерапию)
UBC – urinary bladder cancer (ракмочевогопузыря)
рчГ-КСФ – рекомбинантныйчеловеческий гранулоцитарный колониестимулирующий фактор
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (off-label, офф-лейбл)
Адъювантная химиотерапия– это вид химиотерапии,проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
БЦЖ-терапия – иммунотерапия неактивными бактериямитуберкулеза, которую проводят впослеоперационном периоде с цельюснизить возможность развития рецидива рака мочевого пузыря.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Неоадъювантная химиотерапия – это вид химиотерапии,проводимый непосредственно перед хирургическим удалениемпервичной опухоли для улучшения результатов операцииилилучевой терапии и для предотвращения образования метастазов.
Операция типа Брикера – операция по отведению мочи ввыделенныйучастокподвздошной кишки – создание уростомыили илеального кондуита.
Ортотопическая пластика мочевого пузыря– операция по отведению мочичерезмочеиспускательный канал, которая включаетиспользование различныхвариантовгастроинтестинальныхрезервуаров, соединяемых с мочеиспускательным каналом; ортотопическое отведение мочи (неоцистис, ортотопическаязамена мочевого пузыря).
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Предреабилитация (prehabilitation) – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Трехстаканная проба мочи – это анализ трех порций мочи, полученных при однократном мочеиспускании, который позволяет установить локализацию патологического процесса, вызвавшего повышение количества лейкоцитов и/или эритроцитов в моче.
Трансуретральная резекция мочевого пузыря – это эндоскопическая операция, которая выполняется с целью удаления новообразования/инородного тела мочевого пузыря с последующим микроскопическим исследованием полученной ткани.
Уретерокутанеостомия – хирургическая операция по созданию наружного свища мочеточника путем выведения дистального отдела мочеточника в рану и подшивания его слизистой оболочки к коже.
Уретроцистоскопия – это эндоскопическое вмешательство, которое применяется для визуальной оценки состояния просвета мочеиспускательного канала и мочевого пузыря, уточнения наличия в нем патологических образований, а также одновременного проведения эндоскопических вмешательств.
Уровни достоверности доказательств –отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам, достоверность доказательств определяется по трем основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций – в отличие от уровней достоверности доказательств, отражают не только степень уверенности в достоверности эффекта вмешательства, но и степень уверенности в том, что следование рекомендациям принесет в конкретной ситуации больше пользы, чем негативных последствий.
Фотодинамическое исследование – цистоскопия (введение в мочевой пузырь тонкой металлической трубочки с видеокамерой и освещением), выполняющаяся с использованием фиолетового света после внутрипузырного введения специального препарата, который проникает в опухолевые клетки и светится ярким цветом.
Рак мочевого пузыря (РМП) – тяжелое, в ряде случаев инвалидизирующее заболевание, для которого не разработано системы активного выявления, требующее тщательной дифференциальной диагностики, имеющее большую склонность к рецидивированию и прогрессированию.
РМП – полиэтиологическое заболевание. Значительное число случаев РМП связано с влиянием канцерогенных веществ, выделяемых с мочой, на уротелий.
Курение
Курение табака является наиболее значимым фактором риска для РМП. Табачный дым содержит ароматические амины и полициклические ароматические углеводороды, которые выводятся почками. Вероятность развития РМП у курящих мужчин выше на 50–60 %, а у женщин на 20–30 % по сравнению с некурящими [1, 2]. Имеется прямая связь между риском развития заболевания, количеством выкуриваемых сигарет, длительностью курения, видом табачной продукции [3]. Результаты мета-анализа 216 клинических наблюдений продемонстрировали достоверную взаимосвязь для тех, кто курил ранее, и тех, кто продолжает курить [4]. Продолжительность воздержания после прекращения курения пропорционально сокращает риск развития заболевания. В случае немедленного отказа риск возникновения РМП в течение первых 4-х лет снижался на 40 % и на 60 % – в течение 25 лет [3].
Профессиональные и бытовые вредности
Взаимосвязь профессиональных вредностей с РМП известна более 100 лет. Было продемонстрировано, что у рабочих красильных и резиновых предприятий смертность от РМП в 30 раз выше, чем в популяции. Большинство канцерогенов – ароматические амины и их производные. В настоящее время установлено около 40 потенциально опасных производств: красильные, резиновые, каучуковые, нефтяные, алюминиевые, текстильные, с использованием смол, пластмасс и т.д. [5–8]. Имеются данные о повышенном риске развития РМП среди водителей автотранспорта. Так, в одном из исследований было установлено, что у водителей грузовиков относительный риск заболевания повышен в 1,17 раза, а у водителей автобусов – в 1,33 [8]. Отмечено повышение риска развития заболевания при потреблении воды с высоким содержанием мышьяка (Чили, Аргентина, Тайвань), побочными продуктами хлорирования, полученными при взаимодействии хлора с органическими веществами, содержащимися в воде, которые могут быть канцерогенами [5]. В работе Steinmaus и соавт. показано, что риск развития заболевания при потреблении хлорированной воды у мужчин возрастает в 1,8 раза, а у женщин – в 1,6 [9]. Нет убедительных данных о достоверном влиянии различных продуктов питания [10–13].
Лекарственные вещества
На возникновение РМП способны влиять следующие лекарственные вещества:
Радиация
Радиация увеличивает риск развития РМП у пациентов, перенесших облучение области таза по поводу рака цервикального канала, яичников, предстательной железы, в 1,5–4 раза и пропорционально величине дозы облучения. Наибольший риск развития заболевания выявлен у пациентов, перенесших облучение 5–10 лет назад. Для них характерно развитие высокодифференцированного инвазивного рака [15, 16]. Отмечено, что использование современных подходов облучения с модуляцией интенсивности пучка может улучшить эти показатели, однако требуются отдаленные результаты [17].
Шистосоматоз
Эндемичные районы: Ближний Восток, Юго-Восточная Азия, Северная Африка. Среди заболевших шистосоматозом РМП развивается чаще, чем в популяции. У мужчин риск развития заболевания повышается в 3,9 раза, у женщин — в 5,7 раз. Характерно развитие плоскоклеточного рака [5].
Хронический цистит
Риск развития РМП повышается у пациентов с хроническим циститом, с камнями мочевого пузыря, явлениями уростаза. Для пациентов с длительно стоящими в мочевом пузыре катетерами характерно повышение риска развития аденокарциномы мочевого пузыря [18].
РМП – наиболее часто встречаемая злокачественная опухоль мочевыводящих путей и по распространенности занимает 7-е место в структуре онкопатологии у мужчин и 17-е место у женщин [19]. В зависимости от географического положения уровень заболеваемости РМП в разных странах отличается примерно в десятки раз. Так, в Западной Европе и США заболеваемость выше, чем в Восточной Европе и в странах Азии. В Европейском союзе стандартизованный по возрасту показатель заболеваемости составляет 19,1 для мужчин и 4,0 для женщин[20]. Во всем мире стандартизованный по возрасту коэффициент смертности (на 100 тыс. населения) составляет 3,2 для мужчин и 0,9 для женщин[21]. В структуре онкологической заболеваемости населения России РМП занимает 9-е место среди мужчин и 16-е – среди женщин. Показатель заболеваемости на 100 тыс. населения составил 13,2 для мужчин и 2,3 для женщин. Прирост заболеваемости для обоих полов за последние 10 лет составил 28,3 %. Стандартизованный показатель смертности для мужчин и женщин составил 4,7 и 0,5 соответственно [22]. По возрастному составу преобладают пациенты старше 60 лет, в России они составляют 78,4 %. Средний возраст заболевших в России мужчин – 66,6 года, женщин – 69,6 [22].
РМП встречается у мужчин чаще, чем у женщин (соотношение 3:1), что связано с бόльшим распространением среди мужчин курения и профессий, связанных с канцерогенными веществами, увеличивающими риск развития заболевания [23]. Имеются расовые различия в заболеваемости РМП. Так, в США среди чернокожих мужчин и американских индейцев она соответственно в 2 и 8 раз ниже, а в азиатских поселениях – на 60 % ниже, чем среди белых американцев [18].
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее – МКБ-10), рак мочевого пузыря имеет код:
C67– Злокачественное новообразование пузыря
Классификация МКБ-О
8120/2 Переходно-клеточный рак in situ
8120/3 Переходно-клеточный рак, БДУ
8122/3 Переходно-клеточный рак, веретеноклеточный (саркомоподобный)
8130/1 Папиллярное переходно-клеточное новообразование с низким потенциалом злокачественности
8130/2 Папиллярный переходно-клеточный рак, неинвазивный
8130/3 Папиллярный переходно-клеточный рак
8131/3 Переходно-клеточный рак, микропапиллярный
Классификация TNM (8-е издание)
Классификация TNM 2009 года, утвержденная Международным союзом по борьбе с раком (UICC), была обновлена в 2017 году (8-е издание), но без изменений в отношении опухолей мочевого пузыря[24].
Т – первичная опухоль
Добавление (m) должно быть сделано к соответствующей категории Т для указания
множественности поражения. Добавление (is) может быть сделано к категории Т для указания одновременного присутствия карциномы in situ.
N – регионарные лимфатические узлы (ЛУ)
М – отдаленные метастазы
Наличие лимфоваскулярной инвазии, а также инфильтрация ЛУ имеют независимое прогностическое значение [25,26]. Предполагается, что категория pN напрямую связана с количеством удаленных ЛУ, правильной регистрацией относительно анатомических структур во время лимфаденэктомии, а также подробным изучением их патологом [28].
рTNM – патологоанатомическая классификация Категории рТ, рN, рМ соответствуют категориям T, N, M.
Группировка рака мочевого пузыря по стадиям представлена в табл. 1.
Таблица 1. Группировка рака мочевого пузыря по стадиям
| Стадия | Т | N | M |
| 0 | a, is | 0 | 0 |
| I | 1 | 0 | 0 |
| II | 2a–2b | 0 | 0 |
| III | 3a–4a | 0 | 0 |
| IV | 4b | 0 | 0 |
| Любая | 1–3 | 0 | |
| Любая | Любая | 1 |
Наличие инвазии опухоли в собственную пластинку слизистой оболочки имеет важное прогностическое значение [28, 29]. И тот факт, что в классификации ВОЗ от 2016 года также активно обсуждается внедрение новых подстадий (Т1а–Т1b), является прямым тому доказательством [27, 30]. Однако оптимального решения по этому вопросу не принято [27, 31].
Гистологическая классификация
Классификация ВОЗ (1973 г.)
Классификация ВОЗ (2004 г.): папиллярные новообразования
Классификация ВОЗ (2004 г.): плоские новообразования
PUNLMP – образование, у которого нет цитологических признаков малигнизации, а нормальные клетки уротелия объединяются в папиллярные структуры. Хотя эти опухоли обладают незначительным риском прогрессирования, они не являются абсолютно доброкачественными и имеют тенденцию к рецидивированию [32]. Умеренная степень дифференцировки (G2), которая была предметом дискуссий в классификации ВОЗ (1973 г.), была удалена [33]. Однако опубликованные данные систематического обзора и мета-анализа достоверно не подтвердили, что классификация 2004 года превосходит классификацию 1973 года в прогнозировании рецидивов и прогрессирования[34]. До тех пор, пока прогностическая ценность классификации 2004 года не будет подтверждена бόльшим количеством проспективных исследований, следует пользоваться обеими классификациями [34].
Карцинома insitu (CIS) – плоская неинвазивная опухоль уротелия высокой степени злокачественности, характеризующаяся своей мультифокальностью с различными локализациями (МП, верхние мочевыводящие пути, протоки предстательной железы и уретра). При цистоскопии часто выглядит как участок воспаления. В случае однозначной оценки необходима биопсия [35]. Без лечения более чем у половины пациентов с CIS отмечается прогрессирование: мышечно-инвазивный рак либо метастазы. Выделяют следующие клинические типы CIS[36]:
При оценке наличия/отсутствия CIS в исследуемом материале существует значительная вариабельность среди врачей-патологоанатомов (от 20 до 30 %) [37] (УД 2).
Следует учитывать наличие лимфоваскулярной инвазии после ТУР. Данная ситуация характеризуется высоким риском прогрессирования [38–41] (УД 3). Некоторые гистологические варианты уротелиальной карциномы (микропапиллярный, плазматический, саркоматоидный) наблюдаются редко (5–7% случаев), но обладают худшим прогнозом, чем классическая уротелиальная карцинома [42–49] (УД 3). Изучаются различные маркеры РМП с определением их прогностической значимости [50–54]. Результаты многих исследований являются многообещающими, что приводит к выработке новых, комплексных подходов, основанных на молекулярной классификации. Однако в рутинной практике эти показатели еще не используются [55, 56].
Клинические проявления заболевания зависят от стадии РМП. Начальные стадии чаще всего протекают бессимптомно либо сходны с симптомами других заболеваний мочевыделительной системы, такими как ИМП, простатит, мочекаменная болезнь и т.д.
Безболевая гематурия является самым распространенным проявлением РМП. Отмечено, что макрогематурия связана с более высокой стадией заболевания по сравнению с микрогематурией при ее первом проявлении [57].
Учащенное и болезненное мочеиспускание с наличием императивных позывов, тазовая боль – все это может указывать на инвазивные, распространенные формы РМП. Однако в некоторых случаях такие жалобы могут являться симптомами CIS.
Появление боли в поясничной области связано с блоком устьев мочеточника опухолью и развитием гидронефроза. Боль в костях часто возникает при метастатическом поражении скелета. Симптомы, свидетельствующие о генерализации процесса: слабость, быстрая утомляемость, резкая потеря массы тела, анорексия.
Критерии установления диагноза/состояния:
Клинический диагноз основан на следующих результатах:
Жалобы и анамнез описаны в разделе «клиническая картина»
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии:Физикальное обследование включает в себя бимануальную ректальную и вагинальную пальпацию. Пальпируемая опухолевая масса может быть выявлена у пациентов с местно-распространенными опухолями. Во время наркоза, до и после проведения ТУР МП также целесообразно бимануальное исследование, чтобы оценить, имеется ли пальпируемая масса и фиксирована ли опухоль к стенке таза [58, 59]. Однако, учитывая несоответствие между бимануальным исследованием и стадией pT после цистэктомии (ЦЭ)(11 % клинической переоценки и 31 % недооценки), при интерпретации данных бимануального исследования рекомендуется соблюдать определенную осторожность [60].
при массивной гематурии имеются проявления анемии – бледность кожных покровов, слабость, вялость.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: принемышечно-инвазивных формах РМП бимануальные манипуляции нецелесообразны. В случае тампонады мочевого пузыря, острой задержки мочи переполненный МП пальпируется над лоном, а пациента беспокоят постоянные позывы на мочеиспускание, ощущение распирания в проекции мочевого пузыря, боль в надлобковой области. В то же время при увеличении объема опухоли снижается емкость МП, нарушается его резервуарная функция, что проявляется постоянными позывами на мочеиспускание с небольшим количеством выделяемой мочи, частичным недержанием.
При блоке опухолью устья мочеточника и развитии гидронефроза положителен симптом поколачивания, пальпируется увеличенная почка. При местно-распространенном процессе информативна бимануальная пальпация МП, которая позволяет оценить размеры, подвижность опухоли, наличие инфильтрации окружающих тканей.
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 2).
Комментарии: наиболее адекватным материалом является взятие промывных вод при цистоскопии. ЦИ мочи имеет высокую чувствительность при T1 и G3 (84 %), в случае Та и G1 – низкую (16 %) [61]. Чувствительность при CIS составляет 28–100 % [62] (УД 1В). Данную методику необходимо использовать в качестве дополнения к цистоскопии. Тем не менее стоит отметить, что положительная цитология может указывать на наличие опухоли в любом месте мочевыводящих путей [63]. В свою очередь, негативная цитология не исключает наличие опухоли. Важным является опыт патоцитолога, благодаря чему специфичность может достигать 80 % [64].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии:Патоморфологическое исследование образцаявляется важным в диагностике и лечении РМП. Требуется тесное сотрудничество между врачами-хирургами и врачами-патологоанатомами. Высокое качество предоставленной ткани и клиническая информация необходимы для правильной диагностической оценки. Наличие достаточного количества мышечной ткани в материале необходимо для правильного установления категории Т [82]. В сложных случаях следует рассмотреть вопрос о дополнительном пересмотре материала опытным врачом-патологоанатомом.
В гистологическом заключении следует указывать:
Для патолого-анатомического исследования биопсийного (операционного) материала(гистологического) необходимо использовать классификации ВОЗ 1973 и 2004 гг. Обе классификации следует использовать до тех пор, пока прогностическая роль классификации ВОЗ 2004 г. не будет подтверждена большинством проспективных исследований [32].Необходимо указывать стадию и степень опухолевого процесса при исследовании каждый раз, когда используется термин «немышечно-инвазивный РМП»[83].Использовать термин «поверхностный РМП» не рекомендуется.
Цистоскопия
Диагностика папиллярных форм РМП напрямую зависит от цистоскопического исследования и гистологического заключения на основании холодовой, щипковой биопсии или ТУР-биопсии. В случае подозрения на CIS обязательным является также цитологическое исследование и выполнение множественной рандомной биопсии стенок МП [84].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств –1).
Комментарии: Цистоскопия может быть проведена как амбулаторная процедура. С помощью гибкого цистоскопа с трансуретральным введением местного анестетика достигается лучшая переносимость, особенно у мужчин. Для предупреждения пропуска опухоли должен быть выполнен тщательный осмотр всего эпителия, выстилающего полость МП. Если опухоль МП обнаружена при ранее выполненных визуальных методах исследования, диагностическую цистоскопию можно не выполнять, так как этим пациентам будет проведена ТУР [85, 86].
Диагностическая цистоскопия не должна заменять цитологическое исследование или какие-либо другие неинвазивные методы. При цистоскопии рекомендовано описать все макроскопические характеристики опухоли [87]:
Рекомендуется использовать схему строения МП [88].При проведении диагностической уретроцистоскопии и выявлении новообразования рекомендована биопсия либо выполнение ТУР-биопсии.
Использование флюоресцентной цистоскопии позволяет более точно проводить исследование и более четко определять границы измененных участков, особенно при CIS [89, 90] (УД 1). ФД проводится в фиолетовом свете после внутрипузырной экспозиции фотосенсибилизатора (аминолевулиновая кислота). Чувствительность ФД составляет 80–96 %, специфичность – 65–70 % [90, 91]. Такие факторы, как воспалительный процесс, ТУР, проведенная в ближайшие 3 мес., БЦЖ-терапия, снижают качество метода, увеличивая ложноположительные результаты [92,93]. Другими исследованиями было подтверждено, что в опытных руках частота ложноположительных ответов при ФД была сопоставима с результатами цистоскопии в белом свете [26, 94].
Альтернативным вариантом может быть узкоспектральная визуализация (narrowbandimaging, NBI), не требующая введения сенсибилизаторов. Благодаря специальным фильтрам увеличивается контрастность между неизмененной слизистой и гиперваскулярной опухолевой тканью [95]. Когортныепроспективные исследования продемонстрировали преимущество данного метода при выявлении рецидивов, а также более прецизионное выполнение на его фоне ТУР [96–98]. Однако рандомизированные исследования не показали достоверной разницы в выявлении рецидивов, а также преимуществ данного метода при оценке прогрессирования и смертности [99].
Биопсия
При визуализации подозрительных участков, в случае положительной цитологии, при динамическом контроле, особенно если в анамнезе были ТУР по поводу CIS или T1G3, – во всех случаях показана холодовая биопсия как отдельных участков, так и всех стенок МП [100, 101].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: Биопсия простатического отдела уретры особенно целесообразна в случаях, когда имеется CIS, локализованная в области треугольника или детрузора, а также при высоком риске T1G3. Представленные Palou и соавт. результаты продемонстрировали, что у пациентов с T1G3 частота обнаружения сопутствующей CIS в простатической части уретры составила 11,7 % [102, 103].
ТУР-биопсия является наиболее информативным вариантом биопсии. Пациенту проводится трансуретральное удаление части опухоли мочевого пузыря с подлежащим мышечным слоем и последующей оценкой глубины инвазии [104]. Также при ТУР-биопсии можно более точно оценить первичную опухоль, а именно ее вертикальные и горизонтальные размеры, используя при этом резекционную петлю [105]. Ширина петли составляет 1 см.
Ультразвуковая диагностика
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: УЗИ проводят трансабдоминально, трансректально (у женщин –трансвагинально) при наполненном МП. Необходимо выполнять УЗИ печени при распространенном процессе. Информативность метода резко снижается при опухолях размером менее 5 мм. По информативности метод уступает компьютерной томографии с контрастным усилением [106].
Компьютерная, магнитно-резонансная и позитронно-эмиссионная томография
Уровень убедительности рекомендаций – B(уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: Целесообразно проведение КТ с контрастным усилением, особенно в тех случаях, когда опухоль локализуется в области треугольника Льето, имеются множественные очаги или при опухолях высокого риска – вероятность поражения ВМП при этом резко возрастает [107, 108]. Метод неэффективен при оценке опухолей Та–Т3а [109].
Рекомендуется
МРТ имеет более контрастное изображение органов малого таза по сравнению с КТ, обладает высокой чувствительностью и специфичностью – около 90 %. Особенно высокие показатели зарегистрированы на приборах мощностью (напряженностью поля) в 3,0 Т [110]. При четком соблюдении всех правил выполнения МРТ возможна достаточно точная оценка глубины инвазии. Наиболее значимые результаты отмечены при сопоставлении стадий Т1 и Т2 [111]. Оба метода могут быть использованы при оценке лимфатических узлов, висцеральных и костных очагов. Проведение МРТ головного мозга целесообразно только при наличии неврологической симптоматики [112, 113].
Позитронно-эмиссионная томография, совмещенная с КТ (ПЭТ/КТ), все чаще используется в клинической практике, но ее роль продолжает оцениваться [114].
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 2).
Иные диагностические исследования отсутствуют.
РМП необходимо дифференцировать со следующими патологиями:
3.1.1.Немышечно-инвазивный рак
3.1.1.1. Трансуретральная резекция
Уровень убедительности рекомендаций –С(уровень достоверности доказательств –5).
Комментарии: При ТУР МП удаляют все видимые опухоли. Отдельно удаляют экзофитный компонент и основание опухоли. Это необходимо для правильного установления стадии заболевания (рТ), так как в зависимости от полученных результатов вырабатывают дальнейшую тактику лечения пациента. Проведение ТУР МП с последующим патоморфологическим исследованием –главный этап в лечении НМИ РМП. Целью лечения в данном случае является удаление существующей опухоли с профилактикой рецидива заболевания и предотвращением развития инфильтративной опухоли.
Наиболее распространенными осложнениями ТУР МП являются:
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: Проведение повторной ТУР является обязательной манипуляцией у пациентов группы высокого риска. Исследования демонстрируют достоверные различия в безрецидивной выживаемости и выживаемости без прогрессии [118–121]. Повторная ТУР выполняется через 2–6 недель после первичной процедуры [122].
При некоторых экзофитных опухолях возможна резекция единым блоком (enbloc) с использованием моно- или биполярного тока, а также современных методов: лазеров (тулиевый и гольмиевый) Такая методика обеспечивает высокое качество морфологического материала с наличием мышечного слоя в 96–100 % случаев [123–126].
3.1.1.2. Прогностические группы
Выбор тактики дальнейшего лечения и наблюдения был определен на основании таблиц и номограмм, предложенных Европейской ассоциацией по изучению и лечению рака в 2006 г. [127]. В зависимости от прогностических факторов возникновения рецидива и прогрессии у пациентов с НМИ РМП рекомендована выработка дальнейшей тактики лечения [127]. Вне зависимости от группы риска всем пациентам показана немедленная – в течение 6 часов после ТУР – однократная внутрипузырная инстилляция химиопрепарата.
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 3).
Комментарии: группа низкого риска – уровень инвазии рТа, дифференцировка G1, единичная опухоль менее 3 см, отсутствие CIS. Риск рецидива и прогрессирования опухоли в данной группе за 5 лет – до 37 и 1,7 % соответственно. Смертность за 10 лет – 4,3 %.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 2).
Комментарии: к этой группе относятся все пациенты, не вошедшие в группу низкого или высокого риска. Риск рецидива и прогрессирования опухоли за 5 лет – до 65 и 8 % соответственно. Смертность за 10 лет – 12,8 %.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 2).
Комментарии: группа высокого риска – уровень инвазии рТ1, дифференцировка G3, множественные и рецидивные опухоли; CIS, а также большие опухоли (более 3 см), pTaG1–2 при возникновении рецидива в течение 6 мес. после операции. Эта группа прогностически неблагоприятная. Эффективность внутрипузырной химиотерапии значительно ниже. Вариант выбора у данных пациентов при неэффективности комбинированного органосохраняющего лечения – ЦЭ. Риск рецидива и прогрессирования опухоли за 5 лет – до 84 и 55 % соответственно. Смертность за 10 лет – 36,1 %.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 3).
Комментарии: группа высочайшего риска – уровень инвазии рТ1G3 с CIS; множественные, рецидивные опухоли больших размеров; pT1G3 с CIS в простатическом отделе уретры; редкие гистологические варианты опухоли с плохим прогнозом; опухоли Т1 с лимфоваскулярной инвазией. Эта группа прогностически наиболее неблагоприятная. При отказе пациента от ЦЭпоказана БЦЖ-терапия с поддерживающим режимом в течение 1–3 лет.
3.1.1.3. Карцинома insitu
В случае неадекватного лечения более 50 % пациентов с ранее выявленной CIS прогрессируют в мышечно-инвазивный (МИ) РМП [128]. Считается, что сочетание pТ1G2–3 и CIS имеет более худший прогноз по сравнению с первичной или распространенной CIS и CIS простатического отдела уретры [102, 129–131].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: БЦЖ- терапия должна включать индукционный курс и поддерживающий режим в течение 1–3 лет.
3.1.1.4. Радикальная цистэктомия
Причинами для проведения максимально радикального лечения могут быть:
Существует два условия проведения радикальной ЦЭ у пациентов с НМИ РМП: срочная (незамедлительная) – сразу после установления диагноза РМП без инвазии в мышечный слой и ранняя – после неэффективной БЦЖ-терапии. Ретроспективно показано, что пациентам РМП с высоким риском развития рецидива лучше провести раннюю, чем отсроченную, ЦЭ при выявлении рецидива опухоли после первоначального лечения с использованием ТУР и БЦЖ-терапии, тем самым улучшая результаты выживаемости [127, 132, 143].
Необходимо учитывать влияние радикальной ЦЭ на качество жизни пациентов. Потенциальный положительный эффект от радикальной ЦЭ должен быть соизмеримым с возможными рисками и показателями заболеваемости.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 3).
Комментарии: Возможно проведение повторного курса вакциной для лечения рака мочевого пузыря БЦЖ** либо выбор в пользу органосохраняющего лечения у пациентов, не подходящих для ЦЭ.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: отсрочка в выполнении радикальной ЦЭ может привести к снижению показателей выживаемости. У пациентов с НМИ РМП после радикальной ЦЭ показатели 5‑летней безрецидивной выживаемости превышают 80 % [144–146].
3.1.2. Мышечно-инвазивный рак мочевого пузыря
3.1.2.1. Радикальная цистэктомия
Радикальная ЦЭ является стандартным методом лечения, локализованного МИ РМП [143, 147]. Современное состояние проблемы все чаще требует более индивидуального подхода в лечении инвазивных и распространенных форм РМП. Оценка качества жизнь, работоспособность, ожидаемая продолжительность жизни, общее состояние пациента на момент операции – все это формирует новые тенденции в терапии, такие как комбинированные варианты химиолучевого лечения и органосохраняющей операции [148, 149].
Время от момента постановки диагноза до момента проведения операции точно не установлено, однако имеются данные, что выживаемость была выше в группе пациентов, которым выполнили операцию в течение 90 дней [150–152] (УД 2).
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: Показатели смертности ниже в центрах с большим опытом выполнения радикальной ЦЭ, общая 5-летняя выживаемость после ЦЭ составляет в среднем 40–60 % [153]:
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: общее количество осложнений ЦЭ составляет 9,7–30,0 %. Частота гнойно-септических осложнений достигает 0,28–30 %. Летальность после операции – 1,2–5,1 %. Интраоперационные осложнения достигают 5,3–9,7 %. Кровотечения составляют 3–7 %. Ранения прямой кишки при наличии лучевой терапии в анамнезе – 20–27 %, без лучевой терапии – 0,5–7,0 %.
Наиболее распространенные послеоперационные осложнения [157]:
Наличие только одного метастатического ЛУ (N1) не препятствует выполнению ортотопической пластики, но не в случае N2–3 [158].
У мужчин объем радикальной ЦЭ включает: удаление единым блоком (en bloc) мочевого пузыря с участком висцеральной брюшины и паравезикальной клетчаткой, предстательной железой и семенными пузырьками; тазовую (подвздошно-обтураторную) лимфаденэктомию. При опухолевом поражении простатической части уретры рекомендовано выполнение уретерэктомии [159, 160]. Также у мужчин возможно проведение нервосберегающей операции с сохранением кавернозных сосудисто-нервных пучков с целью профилактики развития эректильной дисфункции [159].
Женщинам рекомендован объем радикальной ЦЭ, включающий переднюю экзентерацию таза и двустороннюю тазовую лимфаденэктомию: удаление мочевого пузыря с участком висцеральной брюшины и паравезикальной клетчаткой, удаление матки с придатками, резекцию передней стенки влагалища [160].
Уровень убедительности рекомендаций – B(уровень достоверности доказательств – 3).
Комментарии: объем тазовой лимфодиссекции включает в себя удаление ЛУ в области наружных и внутренних подвздошных сосудов, в обтураторной ямке, а также пресакральных ЛУ. Расширенная лимфодиссекция также подразумевает удаление ЛУ в области общих подвздошных сосудов до верхней границы – бифуркации аорты. Если краниальной границей служит нижняя брыжеечная артерия, то лимфодиссекция является суперрасширенной [161–165]. Оптимальный объем лимфаденэктомии не определен, однако преимущественное число рандомизированных исследований демонстрирует целесообразность выбора в пользу расширения границ лимфодиссекции как по показателям выживаемости без рецидива и прогрессии, так и по общей выживаемости [166–172].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: Целесообразно сохранение уретры при отсутствии позитивного хирургического края.
3.1.2.2. Лапароскопическая и робот-ассистированная цистэктомия
Использование лапароскопической техники достаточно давно внедрено в практику и имеет большое количество публикаций, посвященных малоинвазивной методике. Эра робот-ассистированных операций – самая молодая среди всех существующих, однако число печатных работ по этой технологии конкурирует с таковыми по лапароскопии [174, 175]. Стоит отметить, что большинство представленных данных имеет низкий уровень доказательности – 4. По-видимому, это обусловлено некорректной стратификацией пациентов [174].Лапароскопическая и робот-ассистированнаяЦЭ рекомендованы к применению у пациентов с РМП, однако до сих пор остаются в фазе изучения. Лапароскопическая и робот-ассистированная техника могут применяться для лечения пациентов как с НМИ, так и с МИ РМП.
3.1.2.3. Варианты деривации мочи
Радикальная ЦЭ включает два непрерывных этапа: удаление мочевого пузыря с лимфодиссекцией и реконструктивно-пластический компонент. Вторым непрерывным этапом и является выбор способа деривации мочи [177]. Возраст >80 лет является противопоказанием к формированию резервуара [178].
Классификация видов деривации мочи:
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: тип отведения мочи не оказывает влияния на онкологические результаты. Не рекомендуется проведение лучевой терапии до оперативного вмешательства при выборе метода лечения с отведением мочи.
3.1.2.3.1. Уретерокутанеостомия
У пациентов пожилого возраста или имеющих выраженные сопутствующие патологии предпочтительным методом является уретерокутанеостомия. Время операции, частота осложнений, пребывание в реанимации и длительность нахождения в стационаре ниже у пациентов после выведения мочеточников на кожу [179, 180]. При наружном отведении мочи пациенту необходимы мочеприемники.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии:существует вероятность стеноза уретерокутанеостомы ввиду малого диаметра самой стомы.
Основные осложнения после операции:
3.1.2.3.2. Гетеротопическийилеокондуит
Данный вариант формирования мочевого резервуара с выведением участка подвздошной кишки и формированием кутанеостомы является наиболее изученным и часто используемым. Тем не менее частота ранних послеоперационных осложнений достигает 48 %. Пиелонефрит как наиболее частое осложнение наблюдается в 30–50 % случаев[181].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 3).
Комментарии: наиболее часто встречающиеся осложнения [182–184]:
3.1.2.3.3. Гетеротопический илеокондуит («сухая» стома)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Хорошее удерживание мочи в дневное и ночное время отмечено многими пациентами и достигает 90 % [188]. Стеноз аппендикулярной стомы встречается в 15–23 % случаев [189]. Выбор данного варианта реконструктивной пластики является достаточно трудоемким и требует навыка и опыта хирурга [190].
3.1.2.3.4. Ортотопический резервуар
Формирование ортотопического резервуара предполагает его расположение в полости таза, на месте удаленного МП, и создание резервуарно-уретрального анастомоза. Этот метод позволяет пациенту в дальнейшем самостоятельно контролировать акт мочеиспускания [147,190,191].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: женщинам также возможно выполнение ортотопической пластики при условии тщательно изученной шейки мочевого пузыря (биопсия с целью выявления опухолевых участков) [192].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: противопоказания для операции – опухолевое поражение уретры ниже семенного бугорка; выраженная хроническая почечная недостаточность.
Наиболее частые осложнения [193]:
3.1.2.4. Органосохраняющие операции (резекция мочевого пузыря)
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: у пациентов с МИ РМП проведение ТУР (открытой резекции МП) с пред- и послеоперационной полихимиотерапией в плане комплексного органосохраняющего лечения рекомендовано при наличии следующих показаний [195–198]:
Показания к выбору органосохраняющего комплексного лечения рекомендовано вырабатывать только в высокоспециализированном онкологическом стационаре. Наличие комплекса современных диагностических методов, направленных на поиск регионарных и отдаленных метастазов, а также возможность длительного и тщательного наблюдения за пациентом являются обязательными условиями.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: ряд авторов считают возможным выполнение ТУР у пациентов с Т2а G1–2 стадией. Несмотря на частоту рецидивов, которая достигает 70%, выживаемость за период 15 лет наблюдения превышает 50%. Необходимо комбинировать ТУР МПс адъювантной терапией, в первую очередь БЦЖ-терапией [199].
3.2.1. Иммунотерапия
Индукционные инстилляции вакциной для лечения рака мочевого пузыря БЦЖ ** классически выполняются в соответствии с эмпирической 6-недельной схемой, которая была предложена Morales и соавт. [200].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: в мета-анализе положительный эффект наблюдался только у пациентов, получивших БЦЖ-терапию по поддерживающей схеме. Используется много различных поддерживающих режимов: от 10 инстилляций, проведенных в течение 18 недель, до 27 более чем за 3 года. С помощью мета-анализа невозможно было определить, какая поддерживающая схема вакцины была наиболее эффективной. Преимущество иммунотерапии перед митомицином** в предупреждении развития рецидива и прогрессирования появляется только при применении БЦЖ-терапии продолжительностью не менее 1 года. Оптимальное количество, частота и длительность поддерживающих индукционных инстилляций остаются неизвестными. Однако результаты рандомизированного контролируемого исследования, куда вошли 1355 пациентов, показали, что проведение поддерживающей БЦЖ-терапии в течение 3 лет с использованием полной дозы вакцины снижает частоту рецидивирования по сравнению с 1 годом лечения в группе высокого риска, но это не относится к пациентам с промежуточным риском. Не наблюдалось различий при сравнении показателей прогрессирования или общей выживаемости [200–204].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: ВАЖНО: первые инстилляции проводятся через 3–4 нед. после ТУР!Вакцина для лечения рака мочевого пузыря БЦЖ**: 50–100 мгв 50мл физиологического раствора хлорида натрия. Вводится еженедельно, в течение 6 нед., далее ежемесячно на протяжении 1 года, либо по схеме: 3 недельные циклы каждые 3, 6, 12, 18, 24, 30, 36 мес. При БЦЖ-рефрактерных опухолях целесообразно выполнение радикальной ЦЭ.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: наличие лейкоцитурии или асимптоматической бактериурии не является противопоказанием для проведения БЦЖ-терапии, в этих случаях нет необходимости в проведении антибиотикопрофилактики. Системные осложнения могут развиться после системной абсорбции лекарственного препарата. Таким образом, следует учитывать противопоказания к внутрипузырной инстилляции [205, 206].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: серьезные побочные эффекты встречаются менее чем у 5 % пациентов и в большинстве случаев могут быть эффективно излечены. Показано, что поддерживающая схема лечения не ассоциирована с повышенным риском побочных эффектов в сравнении с индукционным курсом терапии. Некоторые небольшие исследования показали аналогичную эффективность и отсутствие увеличения количества осложнений по сравнению с неиммунокомпрометированными пациентами. В связи с тем, что БЦЖ-терапия слабо влияет на опухоли с низким риском развития рецидива, рекомендовано рассматривать ее как излишнее лечение для этой когорты пациентов [210].
Также отмечено, что у БЦЖ-терапии больше побочных эффектов, чем у ХТ. По этой причине оба вида лечения (БЦЖ-терапия и внутрипузырная ХТ) остаются возможными методами терапии. При окончательном его выборе следует учитывать риск рецидивирования и прогрессирования для каждого пациента в отдельности так же, как и эффективность и побочные эффекты любого метода лечения.
В случае выявления БЦЖ-рефрактерной опухоли не рекомендовано дальнейшее консервативное лечение с применением вакцины
3.2.2. Химиотерапия
Схемы химиотерапии и иммунотерапии, применяемые при инвазивном и метастатическом РМП и используемые в данном разделе:
Цикл повторяют каждые 4 нед.
Цикл повторяют каждые 3 нед [305].
Цикл повторяют каждые 4 нед. [306]
Цикл повторяют каждые 2 нед.[293]
Иммуноонкологические препараты:
Оценка эффективности проводимой химио- или иммунотерапии проводится на основании критериев ответа солидных опухолей на лечение (RECIST 1.1) [приложение Г3]
3.2.2.1. Внутрипузырная химиотерапия
При использовании ТУР можно полностью удалить макроопухоль, но невозможно повлиять на микроочаги. В результате возникают рецидивы, которые могут в дальнейшем прогрессировать до МИ РМП [117]. Поэтому необходимо рассмотреть вопрос об адъювантной терапии у всех пациентов [211].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: При лечении пациентов с НМИ РМП с высокой вероятностью развития рецидива в первые 3 мес. наблюдения рекомендуется рассматривать назначение адъювантной терапии. Применение внутрипузырной химиотерапии приводит к снижению рецидивов, увеличению продолжительности безрецидивного течения, однако не сказывается на частоте прогрессирования процесса и показателях выживаемости [212].
Ранняя послеоперационная инстилляциянепроводится в случаях явной или предполагаемой перфорации стенки мочевого пузыря, а также пригематурии, когда требуется промывание полости МП.В данном случае среднему медицинскому персоналу необходимо давать четкие инструкции по контролю свободного оттока жидкости по мочевому катетеру. Необходимость в проведении адъювантной внутрипузырной терапии зависит от прогноза рецидива заболевания[213].
В группе пациентовнизкого риска немедленная однократная химиотерапия проводится в качестве полной (завершенной) адъювантной терапии. Данной категории пациентов не требуется лечения до последующего рецидива [214]. Однако для других групп риска однократная немедленная инстилляция является недостаточной из‑завысокой вероятности развития рецидива и/или прогрессирования.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 2).
Комментарии: Длительность экспозиции химиопрепарата также регламентирована. При сравнении 1- и 2‑часовой экспозиций достоверной разницы в безрецидивной выживаемости не отмечено, тем не менее более длительное нахождение препарата в полости мочевого пузыря было ассоциировано с увеличением частоты побочных эффектов [254].
Адаптация рН мочи, снижение дилюции с целью сохранения концентрации химиопрепарата снижают частоту рецидивов и являются важными условиями правильно проведенной инстилляции [216, 217]. При проведении внутрипузырной химиотерапии необходимо использовать лекарственные препараты при оптимальной рН мочи и поддерживать концентрацию препарата в течение экспозиции на фоне снижения потребления жидкости.
У пациентов групп промежуточного и высокого риска после немедленной однократной инстилляции рекомендовано продолжить проведение терапии вакциной для лечения рака мочевого пузыря БЦЖ** в течение 1–3 лет с использованием полной дозы препарата [255].
Остается спорным вопрос о продолжительности и частоте инстилляций химиопрепаратов. Из систематического обзора литературных данных по изучению РМП, где сравнивались различные режимы внутрипузырных инстилляций химиопрепаратов, можно сделать вывод, что идеальная продолжительность и интенсивность режимов остаются неопределенными из‑за противоречивых результатов. Имеющиеся данные не подтверждают эффективность проведения лечения продолжительностью более 1 года [218].
Схемы проведения внутрипузырной химиотерапии:
Внутрипузырная химиотерапия непроводится на протяжении более чем 1 года всем пациентам НМИ РМП вне зависимости от групп риска [219].
3.2.2.2.Неоадъювантная химиотерапия
Применение только хирургического лечения обеспечивает 5‑летнюю выживаемость лишь у 50 % пациентов МИ РМП [191, 220, 221]. С целью улучшения этих результатов более 30 лет применяется неоадъювантная платиносодержащая химиотерапия [222]. Несмотря на столь длительный период использования этого режима терапии, увеличение выживаемости не превышает 8 % [223].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 1).
Комментарии :терапию проводят перед хирургическим или лучевым лечением. Главное преимущество неоадъювантной ХТ – возможность оценить ее воздействие на первичный очаг, что может влиять на тактику дальнейшего лечения [145].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: при использовании цисплатин**-содержащих схем, по разным данным, эффект был достигнут у 40–70 % пациентов. По результатам рандомизированных исследований продемонстрировано статистически значимое увеличение общей выживаемости на 5–8 % среди получавших неоадъювантную ХТ [223-228].
Уровень убедительности рекомендаций – C(уровень достоверности доказательств – 4).
3.2.2.3. Адъювантная химиотерапия
В настоящее время продолжается дискуссия о целесообразности проведения адъювантной ПХТ у пациентов с высоким риском рецидива заболевания после радикальной (R0) ЦЭ(при опухолях рТ3–4 и/или метастатическом поражении регионарных л/у (N+) и отсутствии клинически определяемых отдаленных метастазов) [229]. Некоторые авторы считают, что адъювантная ХТ позволяет улучшить отдаленные результаты лечения в данной группе пациентов в среднем на 20–30 %. Однако вопрос о целесообразности адъювантного лечения, оптимальном режиме химиотерапии и о сроках ее проведения остается предметом клинических исследований. В настоящее время адъювантная ХТ может быть рекомендована пациентам с рТ3–4 и/или N+, не получавшим неоадъювантной химиотерапии [230-232].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств –5).
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: проводились рандомизированные исследования с применением различных схем адъювантной ХТ; в большинстве из них были получены данные о продлении безрецидивного периода по сравнению с контрольной группой (только радикальная ЦЭ) [233-235]. В настоящее время эффективность адъювантной ХТ остается предметом исследований.
3.2.2.4. Химиотерапия при метастатическом РМП
Примерно у 50 % пациентов с МИ РМП возникает рецидив после радикальной ЦЭ. Важное значение при этом имеют рТ первичной опухоли и статус рN. Местные рецидивы отмечены в 30 % случаев, тогда как отдаленные метастазы являются более распространенными [236]. До использования ПХТ у пациентов с метастатическим РМП медианная выживаемость не превышала 6 мес. [237].
Стандартными схемами ПХТ при метастатическом РМП являются схемы MVAC (метотрексат**, винбластин**, доксорубицин**, карбоплатин**) и GC (гемцитабин**, цисплатин**). При отсутствии противопоказаний к назначению цисплатина**его не следует заменять на карбоплатин в химиотерапевтических комбинациях [238]. Высокодозный режим MVAC (DD-MVAC) с поддержкой препаратами гранулоцитарного колониестимулирующего фактора (рчГ-КСФ) менее токсичен, а 2-летняя выживаемость несколько выше, чем при использовании стандартной схемы MVAC. Тем не менее значимые отличия в медиане общей выживаемости между этими режимами отсутствуют [239]. Распространенность опухолевого процесса влияет на показатели отдаленной выживаемости. При поражении только регионарных или отдаленных ЛУ 5-летняя общая выживаемость достигает 20 %, тогда как при наличии висцеральных метастазов – не превышает 6 % [234].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: проведение ПХТ с цисплатином**противопоказано более чем у 50 % пациентов, либо по причине тяжелого общего состояния (ECOG >2, приложение Г1) и/или недостаточной функции почек (клиренс креатинина <60 мл/мин), либо из‑за наличия у них сопутствующей патологии, препятствующей выполнению гипергидратации [240]. В рандомизированном исследовании II–III фазы, в котором сравнивали эффективность схем M‑CAVI и GemCarbo у пациентов, имеющих противопоказания к назначению цисплатина**, оба режима продемонстрировали сопоставимую противоопухолевую активность. При этом частота токсических осложнений 3–4 степени была существенно выше в группе получавших M‑CAVI – 23 и 13 %соответственно [241].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: винфлунин на сегодняшний день является единственным препаратом, который продемонстрировал свое преимущество над плацебо в рандомизированном исследовании 3 фазы, увеличив медиану беспрогрессивной и общей выживаемости с 1,5 до 3 мес. и с 4 до 7 мес. соответственно в общей популяции пациентов[242].
К неблагоприятным прогностическим факторам при проведении 2 линии химиотерапии относятся:
При наличии всех 3-х неблагоприятных факторов прогноза медиана продолжительности жизни не превышает 2 мес. Другим дополнительным фактором, имеющим прогностическое значение при проведении 2 линии химиотерапии, является эффективность 1 линии терапии и время до прогрессирования болезни более 12 мес. от окончания ее проведения. Соответственно, повторное назначение химиотерапии через 12 мес. после ранее достигнутого эффекта на предыдущей линии может быть оправданной тактикой лечения пациентов с благоприятными прогностическими характеристиками.
3.2.2.5. Иммуноонкологическая терапия
Иммуноонкологическая терапия с использованием ингибиторов иммунных контрольных точек моноклональными антителами (МКА), направленными против белка запрограммированной клеточной гибели 1 (PD‑1), его лиганда (PD‑L1) или цитотоксического T-лимфоцит-ассоциированного белка 4 (CTLA‑4) продемонстрировала значительную противоопухолевую активность и длительный ответ на фоне проводимого лечения у пациентов с местно-распространенным и метастатическим РМП [243, 244].
В настоящее время в клинических протоколах исследуется ряд иммуноонкологических препаратов как в монорежиме, так и в сочетании с другими иммунопрепаратами либо со стандартной ПХТ.Пембролизумаб**, #ниволумаб**, атезолизумаб** продемонстрировали аналогичную эффективность у пациентов, имеющих прогрессию во время или после стандартной ХТ на основе платины [245–248, 257].
Для проведения иммунотерапии в 1 линии лечения уротелиального ракапациентам с имеющимся противопоказанием к назначению цисплатина обязательным является PD‑L1-тестирование с помощью тест-систем. Для #пембролизумаба** положительна экспрессия ≥10 %. Для атезолизумаба** положительной является экспрессия ≥5 %.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств 2).
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарий: По данным мета-анализа, включающего 125 клинических исследований и 20 128 пациентов, риск развития нежелательных явлений (≥3 степени) на фоне терапии ингибиторами PD‑1 на 58 % выше, чем при использовании ингибиторов PD‑L1 [249].
К ингибиторам PD-1 относятся: #ниволумаб и пембролизумаб, к ингибиторам PD-L1 – атезолизумаб, дурвалумабиавелумаб.
Воздействию лучевой терапии подлежат переходно-клеточные и плоскоклеточные опухоли. Не показано проведение ЛТ при НМИ РМП. Лучевую терапию по радикальной программе применяют при тотальном поражении стенок мочевого пузыря. При НМИ РМП дистанционную ЛТ применяют с органосохраняющей целью при быстро рецидивирующих или обширных опухолях, при которых невозможна ТУР; при высоком риске прогрессии. Описаны положительные результаты применения ЛТ у пациентов с неудачами БЦЖ-терапии. В целом ЛТ при НМИ РМП применяют редко, рандомизированных сравнительных исследований с другими методами лечения нет.
3.3.1. Самостоятельная лучевая терапия
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: лучевой терапии могут быть подвергнуты пациенты с нормальной функцией мочевого пузыря и достаточной его емкостью при отсутствии ИМТ (режим дозирования указан ниже по тексту)[260].
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 3).
Комментарии: несмотря на рекомендацию, в большинстве случаев проводят дистанционную ЛТ.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: лучевая терапия по радикальной программе проводится в режиме фракционирования с разовой очаговой дозой (РОД) 2 Гр, 5 раз в неделю до суммарной очаговой дозы (СОД) 60–66 Гр непрерывным курсом. При этом, как правило, вначале в объем облучения включается весь таз (мочевой пузырь и зоны регионарного метастазирования) до СОД 44–46 Гр, затем МП и паравезикальная клетчатка 14–16 Гр (до СОД 60 Гр), затем – локально опухоль МП 6 Гр (до СОД 66 Гр). При Т2N0M0 в совокупности с G1–2 возможно проведение радиотерапии без включения в объем облучения на 1 этапе регионарных ЛУ. При наличии протонного комплекса целесообразно использовать энергию протонного пучка 70–250 МэВ. По данным разных авторов, 5-летняя выживаемость колеблется в пределах 24–46 %. При стадии Т2 5-летняя выживаемость составляет 25,3–59,0 %, при стадии Т3 – 9–38% и при стадии Т4 – 0–16 %. Ответ на проведенное лечение наблюдается у 35–70 % пациентов. Частота развития местных рецидивов составляет около 50 %. Осложнения возникают у 15 % пациентов; наиболее распространенные – цистит, гематурия, дизурические явления, проктит, диарея. Более чем у 2/3 мужчин развивается эректильная дисфункция.
3.3.2. Предоперационная лучевая терапия
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 4).
Комментарии: в ряде проведенных исследований показано снижение числа местных рецидивов после предоперационной ЛТ, однако в других исследованиях не отмечено ее влияния на выживаемость и частоту местного рецидивирования.
3.3.3. Послеоперационная лучевая терапия
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: дистанционная радиотерапия проводится на область ложа удаленной опухоли в РОД 2 Гр, 5 раз в неделю до СОД 50 Гр, затем локально на остаточную опухоль РОД 2 Гр, 5 раз в неделю, СОД 10–16 Гр (СОД за оба этапа составит 60–66 Гр). При наличии метастатического поражения регионарных ЛУ на первом этапе ЛТ в объем облучения включаются регионарные лимфатические узлы мочевого пузыря, РОД 2 Гр, 5 раз в неделю, СОД 50 Гр, затем локально, определяемые по данным КТ метастатические лимфатические узлы РОД 2 Гр, 5 раз в неделю, СОД 16 Гр (СОД за оба этапа составит 66 Гр). В связи с изменением топографо-анатомических соотношений после удаления МП отмечают увеличение постлучевых осложнений, особенно со стороны желудочно-кишечного тракта.
Фотодинамическая терапия
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 4).
Комментарии: после внутривенного введения фотосенсибилизатора с помощью лазера проводят обработку слизистой оболочки МП. В ряде работ сообщается об уменьшении количества рецидивов после фотодинамической терапии; в настоящее время осуществляются отработка схем и накопление материала. Дозы препаратов, сроки и режимы лечения зависят от распространенности опухоли по слизистой оболочке МП, характера фотосенсибилизатора и доз лазерного излучения.
3.4.1Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии упациентов с РМП при наличии хронического болевого синдрома соответствуют принципам обезболивания, изложенным в методических рекомендациях «Практические рекомендации по лечению хронического болевого синдрома у онкологических больных» (Коллектив авторов: Когония Л.М., Волошин А.Г., Новиков Г.А., Сидоров А.В., DOI:10.18 027 / 2224–5057–2018–8–3s2–617–635, https://rosoncoweb.ru/standarts/RUSSCO/
2018/2018-47.pdf).
3.4.2. Сопроводительная терапия у пациентов с раком мочевого пузыря
Принципы лечения и профилактики тошноты и рвоты у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (Коллектив авторов: Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю., DOI: 10.18 027/2224–5057–2018–8–3s2–502–511, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-35.pdf).
Принципы лечения и профилактики костных осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (Коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., Семиглазова Т.Ю., DOI: 10.18 027/2224–5057–2018–8–3s2–512–520, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (Коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М., DOI: 10.18 027 / 2224–5057–2018–8–3s2–521–530, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (Коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В., DOI: 10.18 027/2224–5057–2018–8–3s2–531–544, https://rosoncoweb.ru/standarts/RUSSCO/
2018/2018-38.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (Коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А., DOI: 10.18 027/2224–5057–2018–8–3s2–545–563, https://rosoncoweb.ru/standarts/RUSSCO/
2018/2018-39.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (Коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В., DOI: 10.18 027/2224–5057–2018–8–3s2–564–574, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf).
Принципы нутритивной поддержки у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (Коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж., DOI: 10.18 027/2224–5057–2018–8–3s2–575–583, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (Коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А., DOI: 10.18 027/2224–5057–2018–8–3s2–591–603, https://rosoncoweb.ru/standarts/RUSSCO/2018/
2018-44.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (Коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10.18 027/2224–5057–2018–8–3s2–604–609, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-45.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (Автор: Буйденок Ю.В., DOI: 10.18 027/2224–5057–2018–8–3s2–610–616, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf).
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» (Коллектив авторов: Проценко С.А., Антимоник Н.Ю., Берштейн Л.М., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Чубенко В.А., Юдин Д.И., DOI: 10.18 027/2224–5057–2018–8–3s2–636–665, https://rosoncoweb.ru/
standarts/RUSSCO/2018/2018-48.pdf).
3.4.3. Диетотерапия
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: Предположение о том, что сахарин является канцерогеном и вызывает РМП, основанное на экспериментальных результатах, не было подтверждено эпидемиологическими исследованиями. По данным американских исследователей, заболеваемость РМП в 1,5–2 раза выше в населенных пунктах, жители которых в течение длительного времени (40–60 лет) употребляли хлорированную воду из поверхностных источников. Роль питания в этиологии РМП остается неясной, несмотря на достаточно большое количество эпидемиологических исследований, посвященных этой проблеме.
Предреабилитация проводится всем пациентам с МИ РМП, включает физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов.
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций –А(уровень достоверности доказательств – 3).
Комментарии: психологическая поддержка в плане предреабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической предреабилитации, лучше адаптируются к повседневной жизни после хирургического лечения.
4.2.1. Первый этап реабилитации
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 5).
Комментарии: тактикаfast‑trackrehabilitation («быстрый путь») и ERAS (earlyrehabilitationaftersurgery – ранняя реабилитация после операции), включающая в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1–2 суток после операции не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций, а улучшает функциональные возможности в раннем послеоперационном периоде. Данная методика эффективна и безопасна у пациентов урологического профиля. Методика fast‑trackrehabilitation безопасна и эффективна у пациентов и после радикальной ЦЭ.
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций –А(уровень достоверности доказательств – 3).
4.2.2. Обезболивание послеоперационное
Лечение болевого синдрома в послеоперационном периоде носит междисциплинарный характер и помимо медикаментозной коррекции включает в себя физическую реабилитацию (ЛФК), лечение положением, психологические методы коррекции боли (релаксация), чрескожную электростимуляцию, акупунктуру.
Уровень убедительности рекомендаций–С(уровень достоверности доказательств –4).
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 4).
4.2.3. Второй этап реабилитации
Уровень убедительности рекомендаций – A(уровень достоверности доказательств –3).
Комментарии: проводятся занятий ЛФК средней интенсивности по 15–30 минут в день 3–5 раз в неделю, постепенно увеличивая длительность. Сочетаются аэробные нагрузки длительностью 150 минут в неделю и силовые – 2 раза в неделю.
Уровень убедительности рекомендаций –А(уровень достоверности доказательств –2).
4.2.4. Третий этап реабилитации
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – 3).
Комментарии: Упражнения на тренировку баланса более эффективны для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений.
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Профилактика заболевания отсутствует.
При органосохраняющем лечении у пациентов сНМИ РМП:
После радикальной ЦЭ:
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: проводится цистоскопия через 3 мес. пациентам с опухолями ТаT1. Если результат отрицательный, последующую цистоскопию рекомендуется проводить через 9 мес., а затем –ежегодно в течение 5 лет
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Если результат отрицательный, последующие цистоскопию и цитологию необходимо повторять каждые 3 мес. на протяжении 2 лет и далее каждые 6 мес. до 5 лет, а затем – 1 раз в год[286].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 №323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента рака мочевого пузыря врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи – врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с РМП.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации РМП, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациентаРМПв ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с РМП, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с РМП, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с РМП в медицинской организации, оказывающей медицинскую помощь пациентам с РМП, не должен превышать 14 календарных дней с даты гистологической верификации РМП или 14 календарных дней с даты установления предварительного диагноза РМП (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с РМП, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение РМП, требующие использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с РМП, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
Показанием для госпитализации в медицинскую организацию в плановой форме является:
Показанием к выписке пациента из медицинской организации является:
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Наиболее значимые факторы для НМИ РМП, определяющие вероятность рецидива и прогрессии: количество опухолей, их размер, частота рецидивов в анамнезе, категория Т, наличие сопутствующей CIS, степень злокачественности опухоли.
Независимыми факторами, негативно влияющими на общую выживаемость при проведении химиотерапии, являются: статус по шкале Карновского<80 %, оценка по шкале ECOG≤2, (приложение Г1 и Г2) и наличие висцеральных метастазов.
К неблагоприятным прогностическим факторам при проведении 2 линии химиотерапии относят: общее состояние по шкале ECOG >1 (приложение Г1), уровень гемоглобина<10 г/дл. Другим дополнительным фактором, имеющим прогностическое значение при проведении 2 линии химиотерапии, является эффективность 1 линии терапии и время до прогрессирования болезни более 12 мес. после ее применения. Соответственно, повторное назначение химиотерапии через 12 мес. после ранее достигнутого эффекта на предыдущей линии может быть оправданной тактикой лечения пациентов с благоприятными прогностическими характеристиками.
Молекулярная диагностика
Учитывая неоднозначные показатели чувствительности и специфичности ЦИ мочи, были предложены к использованию целый ряд маркеров мочи [65]. Однако ни один из них в настоящее время не применяется в рутинной практике и не указан в клинических рекомендациях. В табл. 2 представлены некоторые диагностические тесты мочи, результаты которых были оценены в различных клинических исследованиях с достаточным количеством пациентов [66–68].
Таблица 2. Краткая информация об основных маркерах, выявляемых в моче
| Маркеры | ОЧ, % | ОС, % | Чувствительность по отношению к опухолям T1G3, % | УД |
| FISH test | 30–86 | 63–95 | 66–70 | 3 |
| Микросателлитныйанализ | 58–92 | 73–100 | 90–92 | 1b |
| Immunocytochemicaltest | 52–100 | 63–75 | 62–92 | 3 |
| NMP22 | 47–100 | 55–98 | 75–83 | 3 |
| bladder tumor antigen test stat | 29–83 | 56–86 | 62–75 | 3 |
| Цитокератины | 12–88 | 73–95 | 33–100 | 3 |
ОЧ – общая чувствительность, ОС – общая специфичность
Имеющиеся данные на основании полученных результатов оценки различных тест-систем позволяют сделать следующие выводы:
| № | Критерии качества | Оценка выполнения |
| 1. | Выполнено ультразвуковое исследование мочевого пузыря | Да/Нет |
| 2. | Проведена цистоскопия | Да/Нет |
| 3. | Проведено патолого-анатомическое исследование биопсийного (операционного) материала, полученного с использованием холодовой, щипковой биопсии или ТУР‑биопсии | Да/Нет |
| 4. | Выполнена магнитно-резонансная томография малого тазас контрастированием | Да/Нет |
| 5. | Выполнено хирургическое лечение пациенту с локализованным или местно-распространенным операбельным раком мочевого пузыря | Да/Нет |
| 6. | Выполнено патолого-анатомическое исследование биопсийного (операционного) материала удаленных тканей | Да/Нет |
| 7. | Отсутствие гнойно-септических осложнений в период госпитализации | Да/Нет |
254. De Bruijn E.A., et al. Pharmacodynamics and pharmacokinetics of intravesical mitomycin C upon diferent dwelling times. Int J Cancer 1992;51(3):359–64.
255. Kamat A.M. et al.Defining and Treating the Spectrum of Intermediate-Risk NMIBC. J Urol. 2014 Aug; 192(2): 305–315.
256. De Luca R. etal. Vinflunine in Metastatic Urothelial Carcinoma of the Bladder in Progression after a Platinum-Containing Regimen. Oncology. 2019 Aug 28:1-7. doi: 10.1159/000502116.
257. Bellmunt, J., et al. Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma.N Engl J Med, 2017. 376: 1015.
258. TripathiA. et al. Immunotherapy for UrothelialCarcinoma: CurrentEvidenceandFutureDirections. CurrUrolRep. 2018 Nov 7;19(12):109. doi: 10.1007/s11934-018-0851-7.]
259. Hafeez, S., et al. Clinical Outcomes of Image Guided Adaptive Hypofractionated Weekly Radiation Therapy for Bladder Cancer in Patients Unsuitable for Radical Treatment. Int J Radiat Oncol Biol Phys, 2017. 98: 115.
260. Tonoli, S., et al. Radical radiotherapy for bladder cancer: retrospective analysis of a series of 459 patients treated in an Italian institution. Clin Oncol (R Coll Radiol), 2006. 18: 52
261. Blank LE, Koedooder K, van Os R, et al. Results of bladder- conserving treatment, consisting of brachytherapy combined with limited surgery and external beam radiotherapy, for patients with solitary T1-T3 bladder tumours less than 5 cm in diameter. Int J Radiat Oncol Biol Phys. 2007;69:454–458.
262. Koning CC, Blank LE, Koedooder C, et al. Brachytherapy after external beam radiotherapy and limited surgery preserves bladders for patients with solitary pT1-pT3 bladder tumors. Ann Oncol. 2012;23:2948–2953.
263. Van der Steen-Banasik EM, Visser AG, Reinders JG, et al. Saving bladders with brachytherapy: implantation technique and results. Int J Radiat Oncol Biol Phys. 2002;3:622–629.
264. Korpics, M., et al. Maximizing survival in patients with muscle-invasive bladder cancer undergoing curative bladder-preserving radiotherapy: the impact of radiotherapy dose escalation.JRadiat Oncol, 2017. 6: 387.
265. Diaz, D.A., et al. Neoadjuvant Radiotherapy Improves Survival in Patients With T2b/T3 Bladder Cancer: A Population-Based Analysis. Clin Genitourin Cancer, 2015. 13: 378.
266. Smith JA Jr. et al. Treatment of advanced bladder cancer with combined preoperative irradiation and radical cystectomy versus radical cystectomy alone: a phase III intergroup study. J Urol, 1997. 157: 805.
267. Ghoneim MA. et al. Randomized trial of cystectomy with or without preoperative radiotherapy for carcinoma of the bilharzial bladder. J Urol, 1985. 134: 266.
268. Zaghloul, M.S. The need to revisit adjuvant and neoadjuvant radiotherapy in bladder cancer. Expert Rev Anticancer Ther, 2010. 10: 1527.
269. El-Monim, H.A., et al. A prospective randomized trial for postoperative vs. preoperative adjuvant radiotherapy for muscle-invasive bladder cancer. Urol Oncol, 2013. 31: 359.
270. Bayoumi, Y., et al. Survival benefit of adjuvant radiotherapy in stage III and IV bladder cancer: results of 170 patients. Cancer Manag Res, 2014. 6: 459.
271. BergerAP. etal. Photodynamic therapy with intravesical instillation of 5-aminolevulinic acid for patients with recurrent superficial bladder cancer: a single-center study.Urology. 2003 Feb;61(2):338-41
272. Oberle AD. et al. Optimizing Nutrition Prior to Radical Cystectomy.CurrUrol Rep. 2018 Oct 18;19(12):99. doi: 10.1007/s11934-018-0854-4.
273. Rammant E. et al. A Systematic Review of Exercise and Psychosocial Rehabilitation Interventions to Improve Health-Related Outcomes in Patients With Bladder Cancer Undergoing Radical Cystectomy. Clin Rehabil, 32 (5), 594-606 May 2018
274. Smith J, Pruthi RS, McGrath J. Enhanced recovery programmes for patientsundergoing radical cystectomy. Nat Rev Urol. 2014;11(8):437–44.
275. Silverdale N. etal. Massage and reflexology for post-operative cancer cystectomy patients: Evaluation of a pilot service.Complement Ther Clin Pract. 2019 Feb;34:109-112. doi: 10.1016/j.ctcp.2018.11.010. Epub 2018 Nov 14.
276. Mehling WE, Jacobs B, Acree M, et al.: Symptom management with massage and acupuncture in postoperative cancer patients: a randomized controlled trial. J Pain Symptom Manage 33 (3): 258-66, 2007.
277. MuziJLet al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. Journal of Clinical Oncology 30, no. 15_suppl (May 2012) 9019-9019 54)
278. Rick O. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. Bioelectromagnetics, 38(2), 85-94.
279. Soukup, V., et al. Follow-up after surgical treatment of bladder cancer: a critical analysis of the literature. Eur Urol, 2012. 62: 290.
280. Mariappan, P., et al. A surveillance schedule for G1Ta bladder cancer allowing efficient use of check cystoscopy and safe discharge at 5 years based on a 25-year prospective database. J Urol, 2005. 173: 1108.
281. van der Aa, M.N., et al. Cystoscopy revisited as the gold standard for detecting bladder cancer recurrence: diagnostic review bias in the randomized, prospective CEFUB trial. J Urol, 2010.183: 76.
282. Niwa, N., et al. Comparison of outcomes between ultrasonography and cystoscopy in the surveillance of patients with initially diagnosed TaG1-2 bladder cancers: A matched-pair analysis. Urol Oncol, 2015. 33: 386 e15
283.SalmanogluE. et al. A glance at imaging bladder cancer. Clin Transl Imaging. 2018 Aug; 6(4): 257–269.doi: 10.1007/s40336-018-0284-9
284. Zuiverloon TCM. etal. Recommendations for follow-up of muscle-invasive bladder cancer patients: A consensus by the international bladder cancer network. Urol Oncol. 2018 Sep;36(9):423-431. doi: 10.1016/j.urolonc.2018.01.014. Epub 2018 Mar 2.
285. Hurle R. etal. Active Surveillance for Low Risk Non-muscle Invasive Bladder Cancer: A Confirmatory and Resource Consumption Study from the BIAS Project.J Urol. 2018 Feb;199(2):401-406. doi: 10.1016/j.juro.2017.08.091. Epub 2017 Aug 26
286. BellmuntJ. etal. Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow-up.Ann Oncol. 2014 Sep;25 Suppl 3:iii40-8. doi: 10.1093/annonc/mdu223. Epub 2014 Aug 5
287. Bus MT. etal. Urothelial carcinoma in the upper urinary tract: developments in diagnostics, treatment and follow-up. NedTijdschrGeneeskd. 2014;158:A7347. Review. Dutch.
288. Kari M. etal. Alternative dosing regimens for atezolizumab: an example of model-informed drug development in the postmarketing setting. Cancer Chemother Pharmacol. 2019; 84(6): 1257–1267.
289. https://reference.medscape.com/drug/keytruda-pembrolizumab-999962
290.http://www.ascopost.com/News/48325?utm_medium=Email&utm_source=ExactTarget&utm_campaign=&utm_term=6301683 (Accessed on February 03, 2017).
291.https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/125554s048s049s050s051s052s061s062s064s065s066lbl.pdf (Accessed on March 26, 2018).
292. Gonzalez M. etal. FunctionalandObjectiveResultsofUrinaryUndiversionsinOncologicPatients. Urology. 2018 Oct;120:244-247. doi: 10.1016/j.urology.2018.06.030. Epub 2018 Jun 30.
293. Choueiri T. et al. Neoadjuvant dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin with pegfilgrastim support in muscle-invasive urothelial cancer: pathologic, radiologic, and biomarker correlates.J Clin Oncol. 2014 Jun 20;32(18):1889-94. doi: 10.1200/JCO.2013.52.4785. Epub 2014 May 12.
294. SundahlN. et al. Pembrolizumab for the treatment of bladder cancer.Expert Rev Anticancer Ther. 2018 Feb;18(2):107-114. doi: 10.1080/14737140.2018.1421461. Epub 2017 Dec 29.
295. Stadler WM. et al. Phase II study of single-agent gemcitabine in previously untreated patients with metastatic urothelial cancer.J Clin Oncol. 1997 Nov;15(11):3394-8.
296. Bamias A, Aravantinos G, Deliveliotis C, et al: Docetaxel and cisplatin with granulocyte colonystimulating factor (G-CSF) versus MVAC with G-CSF in advanced urothelial carcinoma: A multicenter, randomized, phase III study from the Hellenic Cooperative Oncology Group. J Clin Oncol 22:220-228, 2004
297. Dreicer R, Manola J, Roth BJ, et al: Phase III trial of methotrexate, vinblastine, doxorubicin, and cisplatin versus carboplatin and paclitaxel in patients with advanced carcinoma of the urothelium. Cancer 100:1639-1645, 2004
298. Loehrer PJ Sr, Einhorn LH, Elson PJ, et al: A randomized comparison of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: A cooperative group study. J Clin Oncol 10:1066-1073, 1992
299. Balar AV. et al. Pembrolizumab as first-line therapy in cisplatin-ineligible advanced urothelial cancer: results from the total KEYNOTE-052 study population. J Clin Oncol. 2017;35(suppl 6):284–285.
Блок по организации медицинской помощи:
Конфликт интересов:
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Целевая аудитория данных клинических рекомендаций – специалисты, имеющие высшее медицинское образование по следующим специальностям:
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Таблица 3.Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом, или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с контролем референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описания клинического случая |
| 5 | Имеются лишь обоснование механизма действия или мнение экспертов |
Таблица 4.Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в т.ч.когортные исследования |
| 4 | Несравнительные исследования, описания клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеются лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 5.Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества; все рассматриваемые критерии эффективности (исходы) не являются важными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
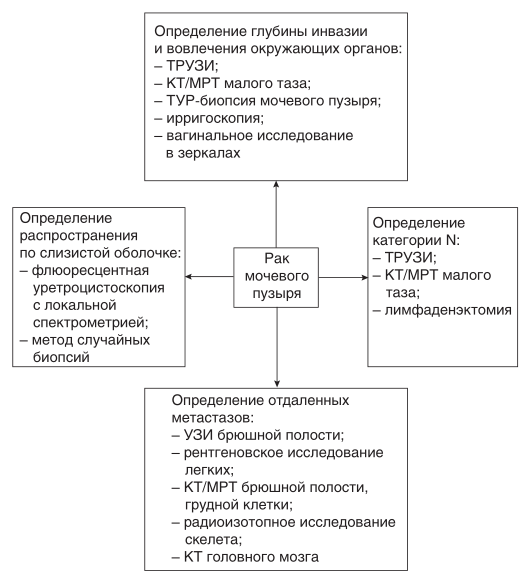
Рисунок 1. Схема первичной диагностики рака мочевого пузыря
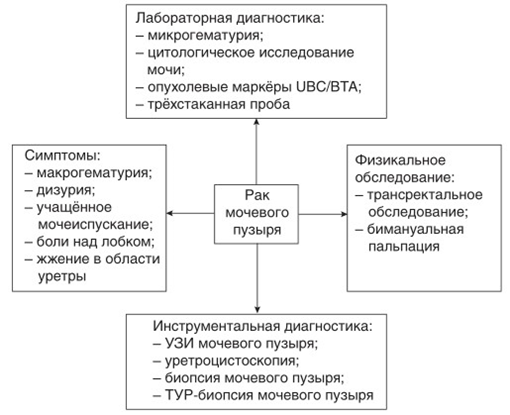
Рисунок 2. Схема уточняющей диагностики рака мочевого пузыря
Рак мочевого пузыря
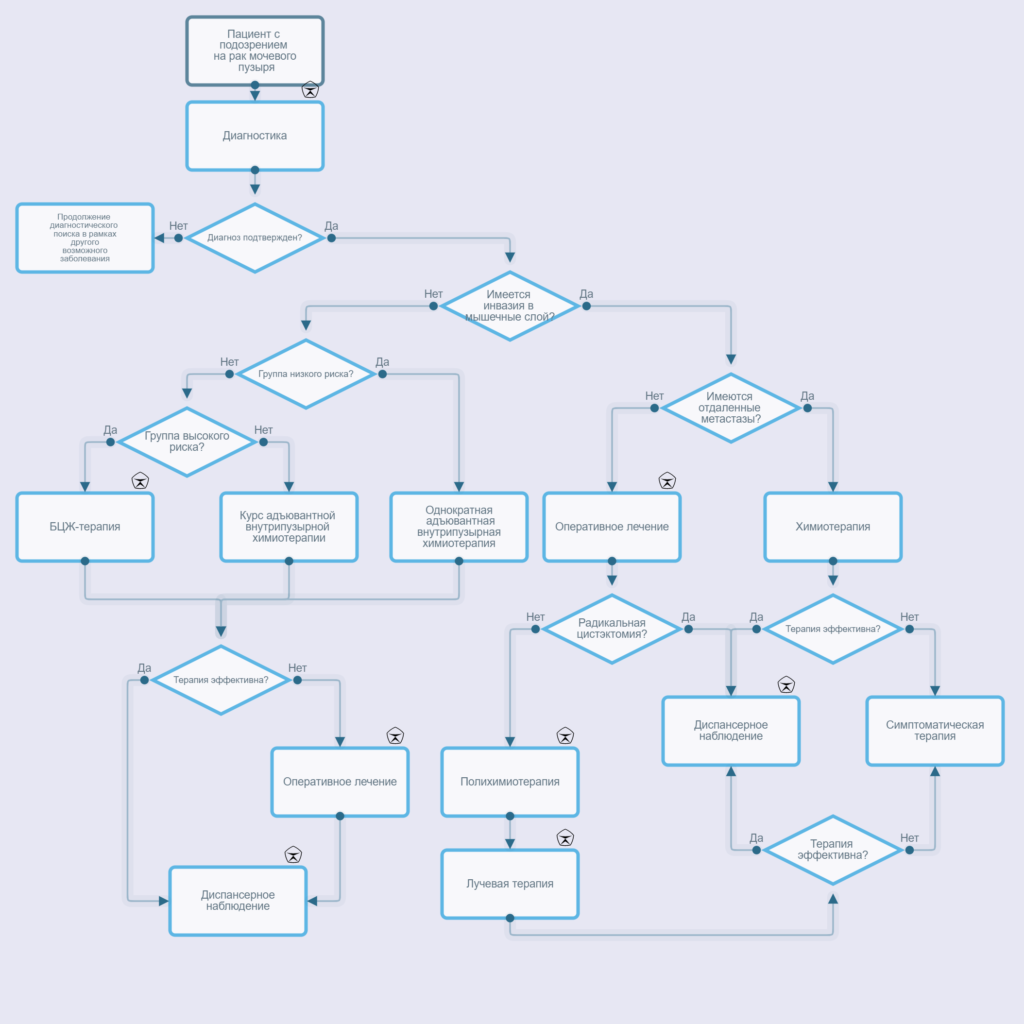
Пациента информируют о клинической картине РМП, знакомят с различными методами лечения, их потенциальными результатами и осложнениями.
Следует информировать пациента о симптоматике, различных осложнениях РМП. Особенно важно предупреждать пациентов с РМП с метастатическим поражением позвонков о возможной компрессии спинного мозга с целью незамедлительного обращения к врачу при возникновении данного осложнения.
Следует информировать пациента о характере последующего наблюдения после лечения РМП, о важности регулярного обследования.
Пациентов с метастатическим РМП следует информировать о проводимых в Российской Федерации клинических исследованиях у пациентов с указанной стадией заболевания.
Самостоятельный контроль за течением заболевания со стороны пациента невозможен; частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Рекомендации при осложнениях химиотерапии – связаться с врачом!
3) При диарее:
4) При тошноте:
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982,5(6):649–655 [250]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа ит.д.)
Содержание (шаблон):
| Балл | Описание |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели |
| 5 | Пациент мертв |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Шкала Карновского
Оригинальное название: KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA,Burchenal JH: The clinicalevaluation of chemotherapeuticagents in cancer. In: Evaluation of chemotherapeutic agents. Edited by MacLeod C. New York: Columbia University Press; 1949: 191–205[251]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.)
Содержание (шаблон):
| Шкала Карновского |
| 100 – Состояние нормальное, жалоб нет 90 – Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 – Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70 – Обсуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 – Нуждается порой в помощи, но способен сам удовлетворять бóльшую часть своих потребностей 50 – Нуждается в значительной помощи и медицинском обслуживании |
| 40 – Инвалид, нуждается в специальной помощи, в т.ч. медицинской 30 – Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 – Тяжелый пациент. Необходимы госпитализация и активное лечение 10 – Умирающий |
| 0 – Смерть |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1)
Оригинальное название: Response evaluation criteria in solid tumors 1.1
Источник (официальный сайт разработчиков, публикация с валидацией):
Оригинальная публикация: EisenhauerEA, TherasseP, BogaertsJ, SchwartzLH, SargentD, FordR, DanceyJ, ArbuckS, GwytherS, MooneyMetal: New response evaluation criteriain solidtumours: revised RECIST guideline (version 1.1). EurJCancer 2009, 45(2):228–247
Тип: шкала оценки
Назначение: оценка ответа на химиотерапевтическое лечение
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический центр медицинской радиологии» Департамента здравоохранения города Москвы и доступны на веб-сайте http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf [252].Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.