Одобрено Научно-практическим Советом Минздрава РФ
ᅠ ᅠ
Скачать в PDF ⟶
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:
C38.1, C38.2, C38.3, C38.8, C48.0, C48.8, C62
Возрастная категория:
Взрослые
Год утверждения:
2020
Год окончания действия:⠀
2022
Статус
Действует
Рабочая группа:
Блок по организации медицинской помощи:
Конфликта интересов нет.
Разработчик клинической рекомендации:
Список сокращений
Термины и определения
АФП – альфа-фетопротеин
ВОЗ – Всемирная организация здравоохранения
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
ЛФК – лечебная физкультура
МКБ-10 – Международная статистическая классификация болезней и проблем, связанных со здоровьем, 10-го пересмотра
МРТ – магнитно-резонансная томография
ОФЭ – орхофуникулэктомия
РФ – Российская Федерация
РФП – радиофармпрепарат
УЗИ – ультразвуковое исследование
ХГЧ – хорионический гонадотропин человека (β-субъединица)
AJCC – American Joint Committee on Cancer
IGCCCG – International Germ Cell Cancer Collaborative Group
UICC – Union for International Cancer Control
TNM – (аббревиатура от tumor, nodus и metastasis) международная классификация стадий развития раковых опухолей
Забрюшинная лимфаденэктомия – хирургическое удаление забрюшинных лимфатических узлов.
Орхофуникулэктомия – хирургическое удаление пораженного первичной опухолью яичка.
Предреабилитация – реабилитация с момента постановки диагноза до начала хирургического лечения/химиотерапии/лучевой терапии.
Первый этап реабилитации – реабилитация в период специализированного лечения
основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений заболевания.
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
Герминогенные опухоли – группа злокачественных опухолей, исходящих из герминативных клеток.
Причина возникновения герминогенных опухолей до сих пор четко не установлена. Имеются данные о повышении риска возникновения опухолей при экзогенной гиперэстрогении (внутриутробной на фоне гестозов, при поступлении с пищей фитоэстрогенов) [1]. Факторами, ассоциированными с возникновением герминогенных опухолей, являются крипторхизм (риск повышается в 5–10 раз), бесплодие (риск повышается в 10–20 раз), синдром тестикулярной дисгенезии, наличие герминогенной опухоли у родственника 1-й степени родства (риск повышается в 5–10 раз) [2-4].
В соответствии с наиболее распространенной теорией герминогенные опухоли яичка происходят из примордиальных герминальных клеток PGCs/гоноцитов, которые находились в «аресте» дифференцировки [5, 6]. Клетки с заблокированной или отсроченной дифференцировкой преждевременно входят в мейоз, что ведет к полиплоидизации и накоплению генетической нестабильности. В процессе опухолевой трансформации PGCs и гоноциты формируют преинвазивные очаги герминогенной опухоли in situ, которая в последующем прогрессирует в инвазивную опухоль и приобретает метастатический потенциал. Герминогенные опухоли in situ всегда обнаруживаются по периферии инвазивных герминогенных опухолей и в 5 % случаях – в контралатеральном яичке.
Герминогенные опухоли – редкое заболевание: в странах Европы и России они составляют около 1,3 % всех случаев опухолей у мужчин. Однако у пациентов 20–25 лет они являются (наряду с лимфомами) наиболее частыми злокачественными новообразованиями. Приблизительно в 90 % случаев герминогенные опухоли локализуются в яичке (составляя до 95 % всех злокачественных опухолей яичка), реже в забрюшинном пространстве, переднем средостении или головном мозге. Эпидемиологические данные о герминогенных опухолях внегонадной локализации в Российской Федерации (РФ) отсутствуют. В 2018 г. в России зарегистрировано 1480 новых случаев опухолей яичка и умерло по этой причине 330 (22 %) пациентов, что в несколько раз превышает летальность в странах Западной Европы (4 %) [7].
По Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (далее ‒ МКБ-10) герминогенные опухоли классифицируются в соответствии с органом первичного происхождения: например, герминогенная опухоль заднего средостения будет иметь код С38.2, а герминогенная опухоль неопустившегося яичка – код С62.0.
Злокачественное новообразование сердца, средостения и плевры (C38)
C38.1 переднего средостения
C38.2 заднего средостения
C38.3 средостения неуточненной части
C38.8 поражение сердца, средостения и плевры, выходящее за пределы одной и более вышеуказанных локализаций
Злокачественное новообразование забрюшинного пространства и брюшины (C48)
C48.0 забрюшинного пространства
C48.8 поражение забрюшинного пространства и брюшины, выходящее за пределы одной и более вышеуказанных локализаций
Злокачественное новообразование яичка (C62)
C62.0 неопустившегося яичка
C62.1 опущенного яичка
C62.9 яичка неуточненное
Международная гистологическая классификация
Международная гистологическая классификация герминогенных опухолей яичка (классификация Всемирной организации здравоохранения (ВОЗ), 2016 г.) [8].
Герминогенные опухоли, происходящие из герминогенной опухоли in situ
Неинвазивные герминогенные опухоли
9064/2 Герминогенная опухоль in situ
9064/2 Специфические формы интратубулярной герминогенной опухоли
Опухоли одного гистологического типа (чистые формы)
9061/3 Семинома
9061/3 Семинома с синцитиотрофобластическими клетками
Несеминомные герминогенные опухоли
9070/3 Эмбриональный рак
9071/3 Опухоль желточного мешка, постпубертатный тип
Трофобластические опухоли
9100/3 Хориокарцинома
Нехориокарциномные трофобластические опухоли
9104/3 Трофобластичскиая опухоль плацентарной площадки
9105/3 Эпителиоидная трофобластическая опухоль
Кистозная трофобластическая опухоль
9080/3 Тератома, постпубертатный тип
9084/3 Тератома со злокачественным компонентом соматического типа
Несеминомные герминогенные опухоли более одного гистологического типа
9080/3 Смешанная герминогенная опухоль
Герминогенные опухоли неизвестного типа
9080/1 Регрессированная герминогенная опухоль
Герминогенные опухоли, не родственные герминогенной опухоли in situ
9063/3 Сперматоцитная опухоль
9084/0 Тератома, препубертатный тип
Дермоидная киста
Эпидермоидная киста
8240/3 Высокодифференцированная нейроэндокринная опухоль (монодермальная тератома)
9085/3 Смешанная тератома и опухоль желточного мешка, препубуртатный тип
9071/3 Опухоль желточного мешка, препубертатный тип
Стадирование
Стадирование опухолей яичка осуществляется в соответствии с классификацией TNM AJCC/UICC (American Joint Committee on Cancer & Union for International Cancer Control) 8-го пересмотра (2017 г.) (табл. 1) [9] , внегонадных опухолей забрюшинного пространства и средостения, а также пациентов с IS, II и III стадиями опухолей яичка –
по классификации International Germ Cell Cancer Collaborative Group (IGCCCG)
(табл. 2) [10] .
Стадирование опухолей яичка по системе TNM AJCC/UICC 8-го пересмотра (2017 г.)
Т – первичная опухоль
За исключением pTis и pT4, при которых выполнение орхофуникулэктомии (ОФЭ) для классифицирования не является абсолютно необходимым, степень распространения первичной опухоли определяется после ОФЭ.
Критерий pT
pTX – недостаточно данных для оценки первичной опухоли (без ОФЭ применяется категория pTХ).
pT0 – первичная опухоль не определяется (например, гистологически верифицирован рубец в яичке).
pTis – герминогенная опухоль in situ.
pT1 – опухоль ограничена яичком и придатком без сосудистой/лимфатической инвазии, опухоль может врастать в белочную оболочку яичка, но не во влагалищную оболочку.
pT2 – опухоль ограничена яичком и придатком, имеется сосудистая/лимфатическая инвазия или опухоль прорастает через белочную оболочку яичка и врастает во влагалищную оболочку.
pT3 – опухоль распространяется на семенной канатик с наличием или без наличия сосудистой/лимфатической инвазии.
pT4 – опухоль распространяется на мошонку с наличием или без наличия сосудистой/лимфатической инвазии.
N – регионарные лимфатические узлы
К регионарным относятся забрюшинные и подвздошные лимфатические узлы. Паховые лимфатические узлы являются для опухолей яичка отдаленными и поражаются редко. Однако если у пациента были нарушены нормальные пути лимфооттока вследствие ранее выполненных оперативных вмешательств в паховой области (низведение яичка, грыжесечение и др.), то метастазы в паховых лимфатических узлах в данном случае определяются как регионарные.
Клиническая оценка
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 – нет признаков поражения метастазами регионарных лимфатических узлов.
N1 – имеются метастазы в одном или нескольких лимфатических узлах <2 см в наибольшем измерении.
N2 – имеются метастазы в одном или нескольких лимфатических узлах <5 см в наибольшем измерении.
N3 – имеются метастазы в лимфатических узлах >5 см в наибольшем измерении.
Патоморфологическая оценка
pNX – недостаточно данных для оценки регионарных лимфатических узлов.
pN0 – метастазы в регионарных лимфатических узлах отсутствуют.
pN1 – имеются метастазы <2 см в наибольшем измерении с поражением до 5 узлов.
pN2 – имеются метастазы <5 см в наибольшем измерении с поражением до 5 узлов или распространение опухоли за пределы узла.
pN3 – метастазы в одном или нескольких лимфатических узлах >5 см в наибольшем измерении.
М – отдаленные метастазы
МХ – недостаточно данных для определения отдаленных метастазов.
М0 – нет признаков отдаленных метастазов.
М1 – имеются отдаленные метастазы.
М1а – поражены метастазами нерегионарные лимфатические узлы или легкие.
М1b – имеются другие отдаленные метастазы.
S – опухолевые маркеры сыворотки крови
SХ – невозможна оценка уровня маркеров в сыворотке крови.
S0 – уровень маркеров соответствует норме.
S1 – уровень лактатдегидрогеназы (ЛДГ) <1,5 N, хорионического гонадотропина человека (ХГЧ) <5,000 мМЕ/мл, альфа-фетопротеина (АФП) <1,000 МЕ/мл.
S2 – ЛДГ 1,5–10 N, или ХГЧ 5,000–50,000 мМЕ/мл, или АФП 1,000–10,000 МЕ/мл.
S3 – ЛДГ >10 N, или ХГЧ >50,000 мМЕ/мл, или АФП >10,000 МЕ/мл.
Таблица 1. Группировка по стадиям в соответствии с классификацией TNM8 (2017)
| Стадия | Критерий T | Критерий N | Критерий M | Критерий S |
| Стадия 0 | pTis | N0 | M0 | S0 |
| Стадия IА | pT1 | N0 | М0 | S0 |
| Стадия IB | pT2–4 | N0 | М0 | S0 |
| Стадия IS | pT любая | N0 | М0 | S1–3 |
| Стадия IIА | pT любая | N1 | М0 | S0–1 |
| Стадия IIB | pT любая | N2 | М0 | S0–1 |
| Стадия IIC | pT любая | N3 | М0 | S0–1 |
| Стадия IIIА | pT любая | Любое N | M1a | S0–1 |
| Стадия IIIB | pT любая | pN1–3 | M0 | S2 |
| pT любая | Любое N | M1a | S2 | |
| Стадия IIIC | pT любая | pN1–3 | M0 | S3 |
| pT любая | Любая N | M1a | S3 | |
| pT любая | Любая N | M1b | Любая S |
Классификация International Germ Cell Cancer Collaborative Group
Таблица 2. Классификация IGCCCG (для опухолей IS, II и III стадий по TNM, первичных опухолей забрюшинного пространства и средостения) [10]
| Прогностическая группа | Клинико-лабораторная характеристика пациентов | |
| Несеминома | Семинома | |
| Благоприятный прогноз56 % пациентов, 5-летняя общая выживаемость – 92 % | Локализация первичной опухоли в яичке или забрюшинном пространстве.Отсутствие нелегочных висцеральных метастазов.АФП <1000 нг/мл*, ХГЧ <5000 мМЕ/мл и ЛДГ <1,5 ВГН | Любая локализация первичной опухоли.Отсутствие нелегочных висцеральных метастазов.Нормальный уровень АФП, любые уровни ХГЧ и ЛДГ |
| Промежуточный прогноз28 % пациентов, 5-летняя общая выживаемость – 80 % | Локализация первичной опухоли в яичке или забрюшинном пространстве.Отсутствие нелегочных висцеральных метастазов.АФП 1000–10000 нг/мл*и/илиХГЧ 5000–50000 мМЕ/мли/илиЛДГ 1,5–10 ВГН | Любая локализация первичной опухоли.Наличие нелегочных висцеральных метастазов |
| Неблагоприятный прогноз16 % пациентов, 5-летняя общая выживаемость – 48 % | Локализация первичной опухоли в средостениии/илиналичие нелегочных висцеральных метастазови/илиАФП >10000 нг/мл*и/илиХГЧ >50000 мМЕ/мли/илиЛДГ >10 ВГН | Варианта неблагоприятного прогноза для семиномы не предусмотрено |
Примечание. АФП – альфа-фетопротеин; ВГН – верхняя граница нормы; ЛДГ – лактатдегидрогеназа; ХГЧ – хорионический гонадотропин человека.
* Для пересчета уровня АФП из МЕ/мл в нг/мл необходимо значение в МЕ/мл умножить на поправочный коэффициент 1,21 (например, 1000 МЕ/мл = 1210 нг/мл).
Опухоль яичка проявляется безболезненным, реже малоболезненным образованием хрящевой плотности с бугристыми краями. Редко заболевание манифестирует остро, что может быть обусловлено перекрутом яичка или острым орхитом. Метастазы в забрюшинных лимфатических узлах чаще проявляются болями в поясничной области, при больших размерах – болями в животе. Следствием высокого уровня ХГЧ может стать двусторонняя гинекомастия. Метастатическое поражение легких и лимфатических узлов средостения может проявляться одышкой, кровохарканьем, синдромом сдавления верхней полой вены.
Критерии установления диагноза/состояния (см. приложения Б1, Б2, Б12):
4) данные инструментального обследования;
5) данные патологоанатомического исследования биопсийного
(операционного) материала..
Клинический диагноз основан на комбинации результатов:
У пациентов с типичной клинической картиной, высокими уровнями опухолевых маркеров (АФП и ХГЧ) при наличии клинически значимых симптомов заболевания вследствие распространенности опухолевого процесса начало химиотерапии возможно и при отсутствии морфологической верификации.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Характерные для пациентов с герминогенными опухолями данные физикального обследования приведены в подразделе 1.6.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: перед каждым курсом химиотерапии необходим общий клинический анализ крови развернутый и биохимический общетерапевтический анализ крови, а также исследование уровня опухолевых маркеров ЛДГ, ХГЧ и АФП (если ранее он был повышен). Остальные анализы выполняются по показаниям.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: небольшую опухоль яичка необходимо взять для исследования полностью, а из опухоли до 10 см в наибольшем измерении берут 1 блок на каждый 1 см опухоли, из крупных опухолей – не менее 10 блоков. Необходимо взять ткань яичка на границе с опухолью и на отдалении от опухоли, яичко и опухоль с белочной оболочкой, так как сосудистую и лимфатическую инвазию лучше всего оценивать в перитуморальной зоне или под белочной оболочкой.
При семиноме не может быть повышенного уровня АФП. Если уровень АФП повышен, лечение должно осуществляться, несмотря на результат патологоанатомического исследования биопсийного (операционного) материала., как при несеминомных опухолях. Высокий (свыше 1000 мМЕ/мл) уровень ХГЧ также позволяет заподозрить наличие несеминомного компонента, и данные опухоли также рекомендуется лечить как несеминомные.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: КТ органов брюшной полости, забрюшинного пространства и грудной полости является стандартом уточняющей диагностики при герминогенных опухолях яичка, забрюшинного пространства и средостения в большинстве развитых стран.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарий: при невозможности выполнить МРТ головного мозга с внутривенным контрастированием (срок ожидания очереди более 1 мес.) допускается выполнить КТ головного мозга с внутривенным контрастированием. Выполнение КТ головного мозга без внутривенного контрастирования не рекомендуется.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: метастатическое поражение костей при герминогенной опухоли явление достаточно редкое. В связи с этим сцинтиграфия костей выполняется только в случаях выявления по данным КТ или МРТ подозрительных в отношении метастатических изменений в костях.
2.5 Иные диагностические исследования
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: возможно выполнение биопсии здорового контралатерального яичка, особенно при его атрофии (объеме <12 мл) в молодом возрасте (до 30 лет), крипторхизме в анамнезе. В этом случае риск герминогенной опухоли in situ достигает 33 % [20] .
Назначение и применение лекарственных препаратов, указанных в клинических рекомендаций, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощи, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
У пациентов с герминогеннымии опухолями используется химиотерапия химиотерапия, включающая цисплатин**, этопозид**, блеомицин**, карбоплатин**, ифосфамид**, #паклитаксел**, гемцитабин**, оксалиплатин** [11,13,21-27]. Принципы выбора препаратов, их комбинаций и числа курсов в зависимости от стадии представлены в разделе 3.4.
Хирургическое лечения при герминогенных опухолях в зависимости от клинической ситуации может включать ОФЭ, резекцию яичка, забрюшинную лимфаденэктомию, удаление новообразования (опухоли) средостения, резекцию легкого, резекцию печени. Показания к каждому вмешательству в зависимости от стадии заболевания представлены в разделе 3.4.
Лучевая терапия (дистанционная лучевая терапия, стереотаксическая лучевая терапия) рекомендуется для лечения герминогенных опухолей редко. Показания к применению, поля облучения и дозы в зависимости от стадии заболевания представлены в разделе 3.4.
См. алгоритмы лечения в приложениях Б3–Б11, Б13[DVL1] [АAT2] .
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: выполнение двойной биопсии яичка повышает шанс обнаружения герминогенной опухоли in situ. При отсутствии лечения в течение 5 лет в 50 % случаев герминогенная опухоль in situ прогрессирует в инвазивную герминогенную опухоль. При выявлении герминогенной опухоли in situ при условии тщательного наблюдения возможна отсрочка в лечении до наступления у партнера беременности.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: резекция яичка не показана при наличии 2-го здорового яичка, но может быть рассмотрена как альтернатива ОФЭ у пациентов с синхронными двухсторонними опухолями, метахронной опухолью контралатерального яичка, опухолью единственного яичка при нормальном дооперационном уровне тестостерона и размере опухоли <30 % от объема органа. С учетом высокой (не менее 82 %) частоты сопутствующей герминогенной опухоли in situ резекция яичка требует обязательного проведения адъювантной локальной дистанционной лучевой терапии на яичко в дозе 16–20 Гр с фракционированием 2 Гр для предотвращения рецидива. У мужчины, планирующего стать отцом, лучевая терапия может быть отложена до наступления беременности у женщины при условии регулярного УЗИ-контроля контралатерального здорового яичка. Лучевая терапия приводит к полной инфертильности и недостаточности функции клеток Лейдига, однако частично гормонопродуцирующая функция может быть сохранена, что уменьшает потребность в заместительной терапии тестостероном [29].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Адекватное время полужизни АФП составляет менее 5–7 дней, ХГЧ – менее 2 дней. Показания к проведению адъювантной химиотерапии определяются факторами риска развития рецидива, возможностью и желанием пациента подвергнуться интенсивному наблюдению в случае отказа от химиотерапии. Важнейший фактор риска при несеминомных опухолях I стадии – наличие лимфоваскулярной инвазии. У пациентов с васкулярной инвазией риск развития рецидива составляет около 50 %, тогда как у пациентов без инвазии – около 20 % [20].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Схема позволяет достичь 97-процентной 5-летней безрецидивной и 99-процентной общей выживаемости. Тем пациентам, которые отказываются от наблюдения или адъювантной химиотерапии, может быть предложено выполнение профилактической нервосберегающей забрюшинной лимфаденэктомии
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: При семиноме факторами риска являются размер первичной опухоли >4 см, инвазия в rete testis. при невозможности/нежелании наблюдения рекомендуется проведение адъювантной терапии по одному из вариантов, обладающих равной эффективностью:
При проведении лучевой терапии важно обеспечить адекватное экранирование здорового яичка.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Процедура должна быть выполнена до проведения химиотерапии.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Если у пациента, ранее не получавшего химиотерапии, в удаленной опухоли обнаружена злокачественная герминогенная опухоль, то ему рекомендуется проведение послеоперационной химиотерапии по программе ВЕР (2 курса после R0-резекции и 4 курса после R1-2 резекции)
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: у пациентов со II–III стадией семиномы повышение уровня ЛДГ выше 2 ВГН является неблагоприятным прогностическим признаком. В таких ситуациях с целью снижения риска прогрессирования рекомендуется интенсификация химиотерапии (проведение 3 курсов по программе ВЕР и 1 курса по программе ЕР) [34].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: Основным видом лечения является химиотерапия. Выбор терапии осуществляется на основе прогностической классификации IGCCCG (см. приложение А3). Принадлежность к прогностической группе определяется по уровню маркеров после выполнения ОФЭ. Альтернатива режиму ВЕР – 4 курса комбинацией PEI (см. приложение А3).
Необходимо помнить о различиях в дозировании препаратов блеомицина**, содержащих активные вещества блеомицетина гидрохлорида (курсовая доза 60 мг) и блеомицина сульфата (курсовая доза 90 мг) (см. приложение А3).
У пациентов в тяжелом общем состоянии, обусловленном распространенностью опухолевого процесса, при наличии типичной клинической картины и высокого уровня АФП или ХГЧ можно начать химиотерапию по срочным показаниям без морфологической верификации диагноза.
Все циклы химиотерапии 1-й линии рекомендуется проводить каждые 3 нед. (считая от начала предыдущего курса химиотерапии). Рекомендуется задержка очередного курса лечения при наличии инфекции, нейтропении (числе нейтрофилов <500 в мкл) или тромбоцитопении (числе тромбоцитов <50 000 в мкл) в 1-й день планируемого курса (табл. 3). Если при проведении предыдущего курса химиотерапии наблюдалась фебрильная нейтропения, нейтропения IV степени длительностью более 7 дней или осложненная инфекцией, рекомендуется профилактическое назначение гранулоцитарного колониестимулирующего фактора при проведении всех последующих курсов химиотерапии [31].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Алгоритм редукции доз химиопрепаратов в зависимости от гематологической токсичности представлен в Приложении А3.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: проведение 1-го курса химиотерапии у таких пациентов сопряжено с высокой частотой осложнений (распада опухоли, кровотечения, инфекция). Особенно это характерно для метастатической хориокарциномы, когда уровень ХГЧ превышает 50 000 мМЕ/мл. По этой причине с целью стабилизации состояния пациента в качестве 1-го курса рекомендуется проведение редуцированного на 40–60 % курса ЕР с дробным введением препаратов или монотерапия карбоплатином** в дозе AUC 7 с последующим профилактическим назначением гранулоцитарного колониестимулирующего фактора. После улучшения состояния пациента, обычно отмечаемого в течение 1-й недели, и восстановления показателей крови проводится химиотерапия во всем запланированном в соответствии с прогнозом IGCCCG объеме.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: При достижении полного эффекта в головном мозге дальнейшее лечение не рекомендуется в связи с редкостью и отсутствием исследований значение локальных методов (лучевой терапии, хирургии) в отношении резидуальных метастазов в головном мозге до конца не определено. В большом ретроспективном анализе было показано, что хирургия или лучевая терапия улучшали выживаемость лишь при добавлении к химиотерапии 2-й и 3-й, но не 1-й линии [37].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: оптимальное время выполнения хирургического вмешательства – через 4–6 нед. после завершения химиотерапии. В случае поражения нескольких анатомических областей хирургическое лечение начинается с зоны максимального поражения. При выполнении забрюшинной лимфаденэктомии крайне важно максимально полно удалить все опухолевые массы. Резекция соседних органов и тканей, включая магистральные сосуды, является оправданной для достижения радикальности. При размере забрюшинных остаточных опухолевых узлов <5 см предпочтительно использовать модифицированные односторонние трафареты для забрюшинной лимфаденэктомии, а также по возможности нервосберегающие методики для сохранения антеградной эякуляции.
Пациенты с полным клиническим ответом либо те, у которых в резецированной резидуальной опухоли обнаружены некроз или тератома, подлежат наблюдению. При наличии в радикально резецированной опухоли жизнеспособных злокачественных клеток рекомендуется проведение 2 курсов химиотерапии по программе TIP. У пациентов с наличием после 2-й и последующих линий терапии жизнеспособных злокачественных клеток в радикально резецированной опухоли проведение послеоперационной терапии не рекомендуется.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: отсутствие накопления РФП в резидуальных метастазах семиномы с большой вероятностью свидетельствует о полном лечебном патоморфозе (имеет высокое негативное предсказывающее значение). Однако накопление РФП чаще обусловлено реактивным воспалением в опухоли после химиотерапии (низкое позитивное предсказывающее значение). В случае накопления РФП в резидуальной опухоли выполнение хирургического вмешательства рекомендуется при условии его безопасности. В ситуациях, когда удаление резидуальной опухоли сопряжено с высоким риском осложнений (например, инвазии магистральных сосудов), возможным вариантом является динамическое наблюдение.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: оптимальный режим 2-й линии терапии – режим TIP, позволяющий добиться высокой выживаемости у 25 % пациентов с несеминомной опухолью и у половины пациентов с семиномой [43, 44]. Альтернативой могут быть режимы PEI (особенно если пациент не получал в 1-й линии терапии этопозид**) и VeIP [45] . Обычно проводится 4 цикла. Не доказано преимущество того или иного режима в качестве 2-й линии терапии. Высокодозная химиотерапия с поддержкой костномозгового кроветворения достоверно не улучшает результаты лечения, однако может применяться в центрах, имеющих опыт ее проведения. Лечение рецидивов заболевания у пациентов с соматической трансформацией тератомы (в саркому, аденокарциному и т. д.) при нормальном уровне опухолевых маркеров (АФП и ХГЧ) осуществляется по принципам лечения соответствующих морфологических вариантов [46].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: этот подход дает шанс спасти около 25 % пациентов, особенно с поздними рецидивами, умеренно повышенным уровнем АФП и забрюшинной локализацией резидуальной опухоли. При бурном прогрессировании с ростом уровня ХГЧ оперативное лечение бессмысленно.
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: доля поздних рецидивов от общего числа рецидивов не превышает 5 %. Особенностью поздних рецидивов является низкая чувствительность к химиотерапии, что позволяет на 1-м этапе рекомендовать хирургическое лечение в случае потенциально резектабельных опухолей даже в случае повышенного уровня опухолевых маркеров. При невозможности радикального удаления опухоли и повышенном уровне опухолевых маркеров необходимо начать химиотерапию 2-й линии с последующим выполнением операции.
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с герминогенными опухолями и хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендации «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
Принципы лечения и профилактики тошноты и рвоты у пациентов с герминогенными опухолями соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» [48].
Принципы лечения и профилактики костных осложнений у пациентов с герминогенными опухолями соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» [49].
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с герминогенными опухолями соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» [50].
Принципы профилактики и лечения гепатотоксичности у пациентов с герминогенными опухолями соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» [51].
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с герминогенными опухолями соответствуют принципам, изложенным в «Практических рекомендациях по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» [52].
Принципы профилактики и лечения кожных осложнений у пациентов с герминогенными опухолями соответствуют принципам, изложенным в «Практических рекомендациях по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» [53].
Принципы нутритивной поддержки у пациентов с герминогенными опухолями соответствуют принципам, изложенным в «Практических рекомендациях по нутритивной поддержке онкологических больных» [54].
Принципы профилактики и лечения нефротоксичности у пациентов с герминогенными опухолями соответствуют принципам, изложенным в «Практических рекомендациях по коррекции нефротоксичности противоопухолевых препаратов» [55].
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с герминогенными опухолями соответствуют принципам, изложенным в «Практических рекомендациях по профилактике и лечению тромбоэмболических осложнений у онкологических больных» [56].
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с герминогенными опухолями соответствуют принципам, изложенным в «Рекомендациях по лечению последствий экстравазации противоопухолевых препаратов» [57].
По результатам корреляционных исследований выдвинуто предположение о роли питания, в частности потребления животных жиров, в этиологии герминогенных опухолей у мужчин.
Не рекомендованы какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции коморбидных состояний, купирования или профилактики осложнений лечения (хирургического, лекарственного или лучевого).
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с герминогенными опухолями. Данные рекомендации сделаны на основании того, что во многих исследований, в том числе метаанализах (Steffens D. et al. 2018 и др.) и систематических обзорах (Nicole L. Stout et al, 2017 и R. Segal et al, 2017 и др.) доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Рекомендуется, при наличии показаний, тренировка дыхательных мышц в ходе предреабилитации перед хирургическим лечением у пациентов, имеющих высокий риск развития легочных осложнений для снижения частоты послеоперационных легочных осложнений и сокращения срока пребывания в стационаре [60]. Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – В (уровень достоверности рекомендаций – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента новообразования яичка, забрюшинного пространства или средостения или при подозрении на него врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала (за исключением новообразования яичка), а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с герминогенными опухолями.
Срок выполнения патологоанатомических исследований, необходимых для морфологической верификации герминогенной опухоли, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента герминогенной опухоли или при появлении подозрения на нее в ходе оказания скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с герминогенными опухолями, для определения тактики ведения и необходимости применения методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с герминогенными опухолями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с герминогенными опухолями в медицинской организации, оказывающей медицинскую помощь пациентам с герминогенными опухолями, не должен превышать 14 календарных дней с даты морфологической верификации герминогенной опухоли или 14 календарных дней с даты установления предварительного диагноза герминогенной опухоли (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с герминогенными опухолями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение герминогенных опухолей, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с герминогенными опухолями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума и вносится в медицинскую документацию пациента.
Проведение химиотерапии пациентам с распространенными стадиями герминогенных опухолей должно проводиться в учреждениях, имеющих достаточный опыт ее проведения (не менее 5 пациентов с неблагоприятным прогнозом по IGCCCG в год). При невозможности проведения химиотерапии в вышеуказанном учреждении – в онкологическом диспансере после определения тактики лечения специалистом центра, имеющего данный опыт (очно или посредством телемедицинской консультации).
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов с привлечением при необходимости других врачей-специалистов.
Для проведения хирургического удаления резидуальной опухоли после химиотерапии (за исключением ОФЭ) пациент направляется в специализированный или федеральный центр, имеющий достаточный опыт данных вмешательств (не менее 10 хирургических вмешательств в год).
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
Показаниями к выписке пациента из медицинской организации являются:
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Известные прогностические факторы при герминогенных опухолях яичка IS, II и III стадии TNM, первичных опухолях забрюшинного пространства и средостения, которые рекомендуется регистрировать, приведены в табл. 2.
| № | Критерии качества | Оценка выполнения |
| 1 | Выполнена морфологическая верификация диагноза до начала лечения, за исключением случаев тяжелого состояния пациента | Да/Нет |
| 2 | Перед орхифуникулэктомией и в послеоперационном периоде определены уровни альфа-фетопротеина, хорионического гонадотропина человека и лактатдегидрогеназы в крови | Да/Нет |
| 3 | При I стадии в заключении патологоанатомического исследования биопсийного (операционного) материала. содержится заключение о наличии или отсутствии сосудистой инвазии, прорастании в сеть яичка | Да/Нет |
| 3 | Адъювантная химиотерапия начата в течение 6 нед. после орхифуникулэктомии (при наличии показаний и отсутствии противопоказаний) | Да/Нет |
| 4 | Пациенту предложена криоконсервация спермы до начала химиотерапии | Да/Нет |
| 5 | Оценена прогностическая группа по IGCCCG перед началом химиотерапии 1-й линии в случае распространенного опухолевого процесса | Да/Нет |
| 6 | Проведен следующий курс полихимиотерапии не позднее 22-го дня с момента начала предыдущего курса полихимиотерапии (при отсутствии медицинских противопоказаний) | Да/Нет |
| 7 | Выполнено удаление резидуальной опухоли при несеминоме | Да/Нет |
1. Sharpe R.M., Skakkebaek N.E. Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract? Lancet 1993;341:1392–5.
2. Garner M.J., Turner M.C., Ghadirian P., Krewski D. Epidemiology of testicular cancer: an overview. Int J Cancer 2005;116:331–9.
3. Chieffi P., Franco R., Portella G. Molecular and cell biology of testicular germ cell tumors. Int Rev Cell Mol Biol 2009;278:277–308.
4. Hemminki K., Chen B. Familial risks in testicular cancer as aetiological clues. Int J Androl 2006;29(1):205–10.
5. Looijenga L.H., de Munnik H., Oosterhuis J.W. A molecular model for the development of germ cell cancer. Int J Cancer 1999;83:809–14.
6. Grigor K.M., Skakkebaek N.E. Pathogenesis and cell biology of germ cell neoplasia: general discussion. Eur Urol 1993;23:46–53.
7. Ferlay J., Colombet M., Soerjomataram I. et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries and 25 major cancers in 2018. Eur J Cancer 2018;103:356–87.
8. WHO classification of tumours of the urinary system and male genital organs. Ed. by H. Moch et al. Lyon: IARC, 2016.
9. Testis. In: TNM classification of malignant tumours (8th ed.). Ed. by J.D. Brierley, M.K. Gospodarowicz, C. Wittekind. Oxford: Wiley-Blackwell, 2017.
10. International Germ Cell Consensus сlassification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997;15:594–603.
11. Oldenburg J., Fosså S. D., Nuver J. et al. ESMO Consensus Conference on testicular germ cell cancer: diagnosis, treatment and follow-up. Ann Oncol 2018;29(8):1658–86.
12. Трякин А.А., Гладков О.А., Матвеев В.Б., с соавт. Практические рекомендации по лекарственному лечению герминогенных опухолей у мужчин //. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-33.pdf .
13. Gilligan T., Lin D.W., Aggarwal R., et al. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Testicular Cancer. Version 1.2020 — October 9, 2019. https://www.nccn.org/professionals/physician_gls/pdf/testicular.pdf.
14. International Collaboration On Cancer Reporting (ICCR). Neoplasia of the testis – orchidectomy histopathology reporting guide. Available at: http://www.iccr-cancer.org/getattachment/Datasets/Published-Datasets/Urinary-Male-Genital/Neoplasia-of-the-Testis-Orchidectomy-TNM8/Testis-Orchidectomy-bookmarked-1st-edition-FINAL-FOR-PUBLICATION.pdf.
15. Tsili A.C., Sofikitis N., Stiliara E., Argyropoulou M.I. MRI of testicular malignancies. . Abdom Radiol (NY) 2019;44(3):1070–82.
16. Hale G.R., Teplitsky S., Truong H. Lymph node imaging in testicular cancer. . Transl Androl Urol 2018;7(5):864–74.
17. Трякин А.А., Федянин М.Ю., Буланов А.А. и др. Метастазы герминогенных опухолей в головной мозг. Опыт Российского онкологического центра. Онкоурология 2013;(4):59–71.
18. Albers P., Göll A., Bierhoff E. et al. Clinical course and histopathologic risk factor assessment in patients with bilateral testicular germ cell tumors. . Urology 1999;54:714–8.
19. Tabernero J., Paz-Ares L., Salazar R. et al. Incidence of contralateral germ cell testicular tumors in South Europe: report of the experience at 2 Spanish university hospitals and review of the literature. J Urol 2004;171:164–7.
20. Kollmannsberger C., Tandstad T., Bedard P. et al. Characterization of relapse in patients with clinical stage I (CSI) nonseminoma (NS-TC) managed with active surveillance (AS): a large multicenter study. J Clin Oncol 2013;(suppl):4503.
21. De Wit R., Roberts J.T., Wilkinson P.M. et al. Equivalence of three or four cycles of bleomy-cin, etoposide, and cisplatin chemotherapy and of a 3- or 5-day schedule in good-prognosis germ cell cancer: a randomized trial of EORTC and MRC. J Clin Oncol 2001;19(6):1629–40.
22. Mead G.M., Cullen M.H., Huddart R. et al. A phase II trial of TIP (paclitaxel, ifosfamide and cisplatin) given as second-line (post-BEP) salvage chemotherapy for patients with meta-static germ cell cancer: a medical research council trial. Br J Cancer 2005;93:178–84.
23. Loehrer P.J., Gonin R., Nichols C.R. et al. Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. . J Clin Oncol 1998;16:2500–4.
24. De Wit R., Stoter G., Sleijfer D.T. et al. Four cycles of BEP vs four cycles of VIP in patients with intermediate-prognosis metastatic testicular non-seminoma: a randomized study of the EORTC Genitourinary Tract Cancer Cooperative Group. European Organization for Research and Treatment of Cancer. Br J Cancer 1998;78:828–32.
25. Kollmannsberger C., Beyer J., Liersch R. et al. Combination chemotherapy with gemcitabine plus oxaliplatin in patients with intensively pretreated or refractory germ cell cancer: a study of the German Testicular Cancer Study Group. J Clin Oncol 2004;22:108–14.
26. Bokemeyer C, Oechsle K, Honecker F, et al. Combination chemotherapy with gemcitabine, oxaliplatin, and paclitaxel in patients with cisplatin-refractory or multiply relapsed germcell tumors: a study of the German Testicular Cancer Study Group. Ann Oncol 2008;19:448–53.
27. Feldman D.R., Sheinfeld J., Bajorin D.F. et al. TI-CE high-dose chemotherapy for patients with previously treated germ cell tumors: results and prognostic factor analysis. J Clin Oncol 2010;28(10):1706–13. Erratum in: J Clin Oncol 2010;28(34):5126.
28. Hoei-Hansen C.E., Rajpert-De Meyts E., Daugaard G., Skakkebaek N.E. Carcinoma in situ testis, the progenitor of testicular germ cell tumours: a clinical review. Ann Oncol 2005;16:863–8.
29. Petersen P.M., Giwercman A., Daugaard G. et al. Effect of graded testicular doses of radiotherapy in patients treated for carcinoma-in-situ in the testis. J Clin Oncol 2002;20:1537–43.
30. Heidenreich A., Höltl W., Albrecht W. et al. Testis-preserving surgery in bilateral testicular germ cell tumours. Br J Urol 1997;79:253–7.
31. Трякин А.А. Лекарственное и комбинированное лечение несеминомных герминоген-ных опухолей у мужчин. Дис. … д-ра мед. наук. М., 2015. 254 с.
32. Cohn-Cedermark G., Stahl O., Tandstad T. Surveillance vs. adjuvant therapy of clinical stage I testicular tumors-a review and the SWENOTECA experience. . Andrology 2015;3:102–10.
33. Albers P. Randomized phase III trial comparing retroperitoneal lymph node dissection with one course of bleomycin and etoposide plus cisplatin chemotherapy in the adjuvant treatment of clinical stage I NSGCT:. AUO trial AH 01/94 by the German Testicular Cancer Study. J Clin Oncol 2008;26(18):2966–72.
34. Fedyanin M, Tryakin A, Bulanov A, et al. Chemotherapy intensification in patients with advanced seminoma and adverse prognostic factors. J Cancer Res Clin Oncol. 2015 Jul;141(7):1259-64.
35. Tran B., Ruiz-Morales J.M., Billalabeitia E.G. Large retroperitoneal lymphadenopathy and increased risk of venous thromboembolism in patients receiving first-line chemotherapy for metastatic germ cell tumors: A study by the global germ cell cancer group (G3). Cancer Med. 2019 Nov 12. doi: 10.1002/cam4.2674. [Epub ahead of print].
36. Tryakin A, Fedyanin M, Bulanov A, et al. Dose-reduced first cycle of chemotherapy for prevention of life-threatening acute complications in nonseminomatous germ cell tumor patients with ultra high tumor markers and/or poor performance status. J Cancer Res Clin Oncol. 2018 Sep;144(9):1817-1823.
37. Feldman D.R., Lorch A., Kramar A. et al. Brain metastases in patients with germ cell tumors: prognostic factors and treatment options-an analysis from the Global Germ Cell Cancer Group. J Clin Oncol 2016;34(4):345–51.
38. Daneshmand S., Albers P., Fossa S.D. et al. Contemporary management of postchemotherapy testis cancer. EurUrol 2012;62:867–76.
39. Tryakin A., Fedyanin M., Mitin A. et al. Complete disappearance of retroperitoneal lymph nodes after induction chemotherapy in advanced nonseminomatous germ cell tumors (NSGCT): is there a place for adjunctive surgery? J Clin Oncol 2012;30(15 suppl).
40. Kollmannsberger C. et. al. Management of disseminated nonseminomatous germ cell tumors with risk-based chemotherapy followed by response-guided postchemotherapy surgery. . J Clin Oncol 2010;28:537.
41. De Santis M., Becherer A., Bokemeyer C. et al. 2-18Fluoro-deoxy-D-glucose positron emis-sion tomography is a reliable predictor for viable tumor in postchemotherapy seminoma: an update of the prospective multicentric SEMPET trial. J Clin Oncol 2004;22:1034–9.
42. Cathomas R., Klingbiel D., Bernard B. et al. Questioning the value of fluorodeoxyglucose positron emission tomography for residual lesions after chemotherapy for metastatic seminoma: results of an International Global Germ Cell Cancer Group Registry. J Clin Oncol 2018;4:JCO1800210. .
43. Motzer R.J., Sheinfeld J., Mazumdar M. et al. Paclitaxel, ifosfamide, and cisplatin second-line therapy for patients with relapsed testicular germ cell cancer. J Clin Oncol 2000;18(12):2413–8. .
44. Mead G.M., Cullen M.H., Huddart R. et al. A phase II trial of TIP (paclitaxel, ifosfamide and cisplatin) given as second-line (post-BEP) salvage chemotherapy for patients with metastatic germ cell cancer: a medical research council trial. Br J Cancer 2005;93:178–84. .
45. Loehrer P.J., Gonin R., Nichols C.R. et al. Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. J Clin Oncol 1998;16:2500–4.
46. Donadio A.C., Motzer R.J., Bajorin D.F. et al. Chemotherapy for teratoma with malignant transformation. . J Clin Oncol 2003;21(23):4285–91.
47. S., Daneshmand. Role of surgical resection for refractory germ cell tumors. Urol Oncol 2015;33(8):370–8.
48. Владимирова Л. Ю., Гладков О. А., Когония Л. М., Королева И. А., Семиглазова Т.Ю. Практические рекомендации по профилактике и лечению тошноты и рвоты у онколо-гических больных // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том . локачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 502–511. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-35.pdf.
49. Манзюк Л. В., Багрова С. Г., Копп М. В., Кутукова С. И., Семиглазова Т. Ю. Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях // . Злокачественные опухоли: Практиче-ские рекомендации RUSSCO #3s2, 2018 (том 8). С. 512–520. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf.
50. Сакаева Д. Д., Орлова Р. В., Шабаева М. М. Практические рекомендации по лечению инфекционных осложнений фебрильной нейтропении и назначению колониестимули-рующих факторов у онкологических больных //. Злокачественные опухоли: Практические реко-мендации RUSSCO #3s2, 2018 (том 8). С. 521–530. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf.
51. Ткаченко П. Е., Ивашкин В. Т., Маевская М. В. Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией // . Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 531–544. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-38.pdf.
52. Виценя М. В., Агеев Ф. Т., Гиляров М. Ю., с соавт. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии // . Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 545–563.
53. Королева И. А., Болотина Л. В., Гладков О. А., с соавт. Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию //. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 564–574. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf.
54. Сытов А. В., Лейдерман И. Н., Ломидзе С. В., с соавт. Практические рекомендации по нутритивной поддержке онкологических больных //. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 575–583. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf.
55. Громова Е. Г., Бирюкова Л. С., Джумабаева Б. Т., Курмуков И. А. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов // . Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 591–603. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-44.pdf.
56. Сомонова О. В., Антух Э. А., Елизарова А. Л., с соавт. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных // . Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 604–609. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-45.pdf.
57. Буйденок Ю.В. Рекомендации по лечению последствий экстравазации противоопухолевых препаратов // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 610–616. https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf.
58. Silver J.K., Baima J. Cancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013;92(8):715–27.
59. Nilsson H., Angeras U., Bock D. et al. Is preoperative physical activity related to post-surgery recovery? A cohort study of patients with breast cancer. BMJ Open 2016;6(1):e007997.
60. Hulzebos E.H., Helders P.J., Favie N.J. et al. Preoperative intensive inspiratory muscle training to prevent postoperative pulmonary complications in high-risk patients undergoing CABG surgery: a randomized clinical trial. JAMA 2006;296(15):1851–7.
61. Tsimopoulou I., Pasquali S., Howard R. et al. Psychological Prehabilitation Before Cancer Surgery: A Systematic Review. Ann Surg Oncol 2015;22(13):4117–23.
62. Swarm R., Abernethy A.P., Anghelescu D.L. et al. Adult cancer pain. J Natl Compr Canc Netw 2010;8:1046–86.
63. Azhar R.A., Bochner B., Catto J. et al. Enhanced recovery after urological surgery: a contemporary systematic review of outcomes, key elements, and research needs. Eur Urol 2016;70(1):176–87.
64. Nilsson H., Angeras U., Bock D. et al. Is preoperative physical activity related to post-surgery recovery? A cohort study of patients with breast cancer. BMJ Open 2016;6(1):e007997.
65. Shin K.Y., Guo Y., Konzen B. et al. Inpatient cancer rehabilitation: the experience of a national comprehensive cancer center. Am J Phys Med Rehabil 2011;90(5):63–8.
66. Shehadeh A., El Dahleh M., Salem A. et al. Standardization of rehabilitation after limb salvage surgery for sarcomas improves patients” outcome. Hematol Oncol Stem Cell Ther 2013;6(3–4):105–11.
67. Fallon M., Giusti R., Aielli F. et al. Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines. . Ann Oncol 2018;29(Suppl 4):iv166–91.
68. Cox C.L., Montgomery M., Oeffinger K.C. et al. Promoting physical activity in childhood cancer survivors: results from the Childhood Cancer Survivor Study. Cancer 2009;115(3):642–54.
69. Musculoskeletal Cancer Surgery. Ed. by M. Malawer. Dordrecht: Springer, 2013. Pp. 583–593.
70. Committee NMA: The diagnosis and treatment of lymphedema. Position Statement of the National Lymphedema Network. 2011. 19 p.
71. Segal R., Zwaal C., Green E. et al. Exercise for People with Cancer Guideline Development G: Exercise for people with cancer: a systematic review. . Curr Oncol 2017;24(4):e290–315.
72. Boyd C., Crawford C., Paat C.F. et al. Evidence for Massage Therapy Working G: The impact of massage therapy on function in pain populations-a systematic review and meta-analysis of randomized controlled trials: Part II, Cancer pain populations. Pain Med 2016;17(8):1553–68.
73. Stout N.L., Baima J., Swisher A.K. et al. A systematic review of exercise systematic reviews in the cancer literature (2005–2017). PM R 2017;9(9S2):S347–84.
74. Hu M., Lin W. Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol 2012,127(3):156–64.
75. Mustian K.M., Alfano C.M., Heckler C. et al. Comparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017;3(7):961–8.
76. Kinkead B., Schettler P.J., Larson E.R. et al. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. Cancer 2018;124(3):546–54.
77. Streckmann F., Zopf E.M., Lehmann H.C. et al. Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014;44(9):1289–304.
78. Kleckner I.R., Kamen C., Gewandter J.S. et al. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. . Support Care Cancer 2018;26(4):1019–28.
79. Lee J.M., Look R.M., Turner C. et al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. J Clin Oncol 2012;30(15 suppl):9019.
80. Rick O., von Hehn U., Mikus E. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. . Bioelectromagnetics 2017;38(2):85–94.
81. Kilinc M., Livanelioglu A., Yildirim S.A., Tan E. Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med 2014;46(5):454–60.
82. Oberoi S., Zamperlini-Netto G., Beyene J. et al. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014;9(9):e107418.
83. Westphal J.G., Schulze P.C. Exercise training in cancer related cardiomyopathy. J Thorac Dis 2018;10(Suppl35):S4391–9.
84. Ross M., Fischer-Cartlidge E. Scalp cooling: a literature review of efficacy, safety, and tolerability for chemotherapy-induced alopecia. Clin J Oncol Nurs 2017;21(2):226–33.
85. Rief H., Omlor G., Akbar M. et al. Feasibility of isometric spinal muscle training in patients with bone metastases under radiation therapy – first results of a randomized pilot trial. BMC Cancer 2014;14:6.
86. Bensadoun R.J., Nair R.G. Low-level laser therapy in the management of mucositis and dermatitis induced by cancer therapy. . Photomed Laser Surg 2015;33(10):487–91.
87. Temoshok L. Biopsychosocial studies on cutaneous malignant melanoma: psychosocial factors associated with prognostic indicators, progression, psychophysiology and tumor-host response. Soc Sci Med 1985;20(8):833–40.
88. S.R., Dirksen. Perceived well-being in malignant melanoma survivors. Oncol Nurs Forum 1989;16(3):353–8.
89. Lichtenthal W.G., Cruess D.G., Schuchter L.M., Ming M.E. Psychosocial factors related to the correspondence of recipient and provider perceptions of social support among patients diagnosed with or at risk for malignant melanoma. J Health Psychol 2003;8(6):705–19.
90. Sollner W., Zschocke I., Zingg-Schir M. et al. Interactive patterns of social support and individual coping strategies in melanoma patients and their correlations with adjustment to illness. Psychosomatics 1999;40(3):239–50.
91. Devine D., Parker P.A., Fouladi R.T., Cohen L. The association between social support, intrusive thoughts, avoidance, and adjustment following an experimental cancer treatment. . Psychooncology 2003;12(5):453–62.
92. Chovanec M., Abu Zaid M., Hanna N. et al. Long-term toxicity of cisplatin in germ-cell tumor survivors. Ann Oncol 2017;28(11):2670–9.
Блок по организации медицинской помощи
Конфликта интересов нет.
Целевая аудитория данных клинических рекомендаций:
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме герминогенных опухолей в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Уровни достоверности доказательств в соответствии с методическими рекомендациями по разработке и актуализации клинических рекомендаций (приказ Минздрава России от 28.02.2019 № 103н)
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Уровни достоверности доказательств с указанием использованной
классификации уровней достоверности доказательств (УДД)
| УДД | Расшифровка |
| 1 | Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение эксперта |
Таблица 3. Уровни убедительности рекомендаций (УУР) с указанием использованной
классификации уровней убедительности рекомендаций
| УУР | Расшифровка |
| А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ. Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
Описание метода валидизации рекомендаций. Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии врачей-онкологов и урологов первичного звена о доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка. Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения мужчин с герминогенными опухолями, но не чаще 1 раза в 6 месяцев. Решение об обновлении принимает МЗ РФ на основе предложений, внесенных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Схемы химиотерапии, применяемые в лечении герминогенных опухолей
| Режим | Препараты | Введение | Дни лечения | Показания |
| Режимы 1-й линии химиотерапии | ||||
| ЕР | этопозид** 100 мг/м2 | в/в, 40 мин | 1–5-й дни | 4 курса – благоприятный прогноз (при противопоказаниях к блеомицину), длительность курса – 21 день |
| цисплатин** 20 мг/м2 | в/в, 1 ч | 1–5-й дни | ||
| ВЕР | блеомицин**3 30 мг | в/в, 2–20 мин | 1, 3, 5-й дни | 3 курса – благоприятный прогноз, 4 курса – промежуточный/ неблагоприятный прогноз, длительность курса – 21 день |
| этопозид** 100 мг/м2 | в/в, 40 мин | 1–5-й дни | ||
| цисплатин** 20 мг/м2 | в/в, 1 ч | 1–5-й дни | ||
| PEI | этопозид** 75 мг/м2 | в/в, 40 мин | 1–5-й дни | 4 курса – промежуточный/ неблагоприятный прогноз (при противопоказаниях к блеомицину как альтернатива ВЕР), длительность курса – 21 день |
| ифосфамид 1200 мг/м2 | в/в, 1–2 ч | 1–5-й дни | ||
| цисплатин**20 мг/м2 | в/в, 1 ч | 1–5-й дни | ||
| месна** | в/в, струйно2 | 1–5-й дни | ||
| Режимы 2-й линии химиотерапии | ||||
| TIP [19] | ифосфамид 1500 мг/м2 | в/в, 1–2 ч | 2–5-й дни | 4 курса – предпочтительный режим 2-й линии, длительность курса – 21 день |
| цисплатин** 25 мг/м2 | в/в, 1 ч | 2–5-й дни | ||
| месна**2 | в/в, струйно2 | 2–5-й дни | ||
| #паклитаксел** 120 мг/м2 | в/в, 1 ч | 1-й, 2-й дни | ||
| филграстим** 5 мкг/кг | п/к | 6–15-й дни | ||
| VeIP | ифосфамид 1200 мг/м2месна**2 | в/в, 1–2 чв/в, струйно2 | 1–5-й дни1–5-й дни | 4 курса – стандартный режим 2-й линии, длительность курса – 21 день |
| цисплатин**1 20 мг/м2 | в/в, 1 ч | 1–5-й дни | ||
| винбластин** 0,11 мг/кг | в/в струйно | 1-й, 2-й дни | ||
| филграстим** 5 мкг/кг | п/к | 6–15-й дни |
| Режим | Препараты | Введение | Дни лечения | Показания |
| Режимы 3-й линии химиотерапии | ||||
| TGO [39] | #паклитаксел** 80 мг/м2 | в/в, 1 ч | 1-й, 8-й дни | 4 курса, длительность курса – 21 день |
| гемцитабин** 800 мг/м2 | в/в, 30 мин | 1-й, 8-й дни | ||
| оксалиплатин** 130 мг/м2 | в/в, 2 ч | 1-й день | ||
| GemOX [38] | гемцитабин** 1000 мг/м2 | в/в, 30 мин | 1-й, 8-й дни | 4 курса, длительность курса – 21 день |
| оксалиплатин** 130 мг/м2 | в/в, 2 ч | 1-й день | ||
| Высокодозная химиотерапия с трансплантацией клеток-предшественников гемопоэза(2–3-й линии) [40] | ||||
| TI | #паклитаксел** 200 мг/м2 | в/в, 3 ч | 1-й день | 1–2 курса, длительность курса – 2 нед. (в перерыве – лейкаферез до сбора CD34+ клеток ≥8 × 106/кг) |
| ифосфамид 2000 мг/м2 | в/в, 1–2 ч | 1–3-й дни | ||
| месна** | в/в, струйно* | 1–3-й дни | ||
| филграстим** 10 мкг/кг | п/к | 4–12-й дни | ||
| СЕ | карбоплатин** AUC 8 | в/в | 1–3-й дни | 3 курса, длительность курса – 3 нед. |
| этопозид** 400 мг/м2 | в/в | 1–3-й дни | ||
| филграстим** 5 мкг/кг | п/к | 4–12-й дни | ||
| CD34+ клетки ≥2 × 106/кг | в/в | 5-й день |
1Ведение цисплатина** осуществляется на фоне внутривенной гидратации физиологическим раствором натрия хлорида (суммарный суточный объем 2,5 л), необходимой для поддержания диуреза >100 мл/ч в процессе введения цисплатина** и в последующие 3 ч.
2 Месна** применяется в суточной дозе, составляющей 100 % от дозы ифосфамида** и разделенной на 3 введения в течение дня: непосредственно перед ифосфамидом** и далее через 4 и 8 ч после начала его инфузии.
3 Активные вещества блеомицетина гидрохлорид (изомер А5) и блеомицина сульфат (смесь изомеров А2 и В2) не являются идентичными лекарственными средствами. При использовании блеомицина сульфата в режиме ВЕР используются дозы по 30 мг 1, 3, 5-й (или 1, 8, 15-й) дни. При использовании менее изученного блеомицетина гидрохлорида рекомендуется применять меньшие на 30–40 % курсовые дозы препарата, например, по 30 мг 1-й, 5-й дни.
Алгоритм редукции доз химиопрепаратов в зависимости от гематологической токсичности* [15]
| Число нейтрофилов, 109/л | Величина редукции дозы, %, при числе тромбоцитов, 109/л | ||||||
| ≥100 | 75–99 | 50–74 | <50 | ||||
| Этопозид** | Цисплатин** | Этопозид** | Цисплатин** | Этопозид** | Цисплатин** | Этопозид** | Цисплатин** |
| ≥1,0 | 100 % | 100 % | 75 % | 100 % | 50 % | 100 % | отсрочка |
| 0,50–0,99 | 100 % | 100 % | 50 % | 100 % | отсрочка | отсрочка | |
| <0,5 | отсрочка | отсрочка | отсрочка | отсрочка |
* Определяется по результатам анализов в день начала очередного курса химиотерапии.
Обследование и первичное лечение пациентов с опухолями яичка
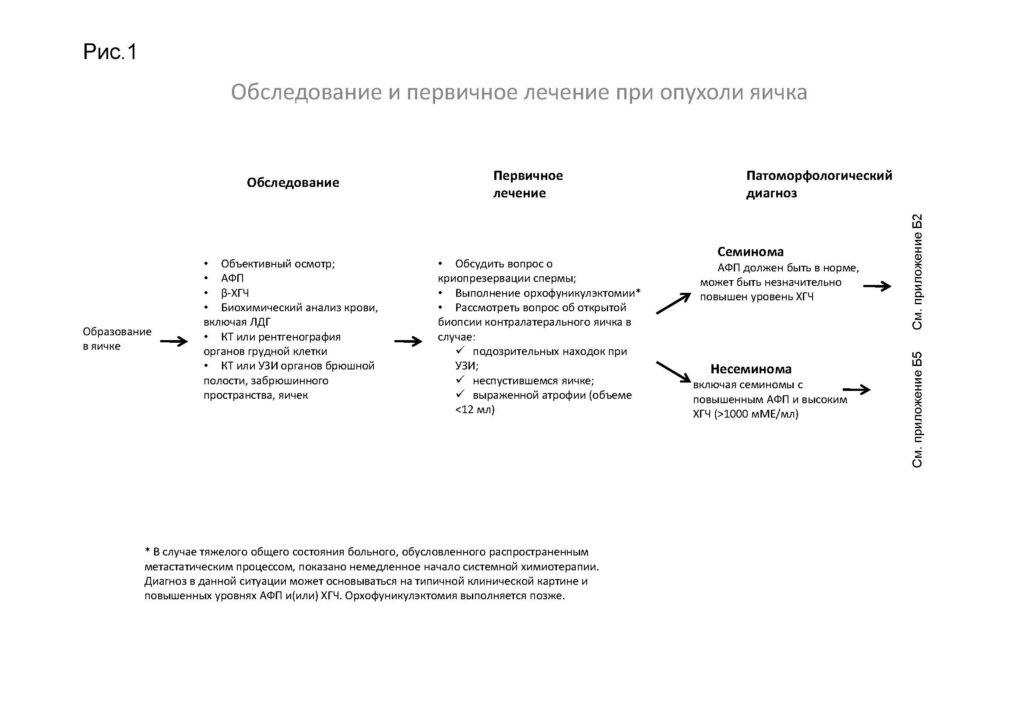
*В случае тяжелого общего состояния пациента, обусловленного распространенным метастатическим процессом, показано немедленное начало системной химиотерапии. Диагноз в данной ситуации может основываться на типичной клинической картине и повышенных уровнях АФП и(или) ХГЧ. Орхофуникулэктомия выполняется позже.
Обследование и первичное лечение при семиноме
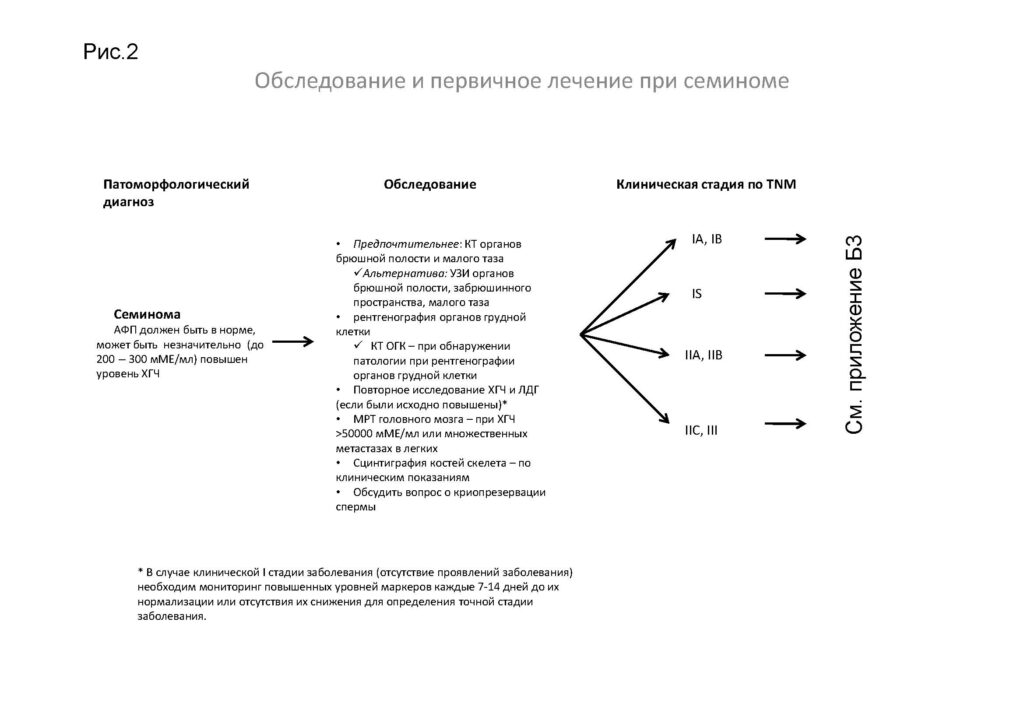
*В случае клинической I стадии заболевания (при отсутствии проявлений заболевания) необходим мониторинг повышенных уровней маркеров каждые 7–14 дней до их нормализации или отсутствия их снижения для определения точной стадии заболевания.
Лечение пациентов с семиномой

Стадии IIB, IIC, III семиномы после проведенной химиотерапии
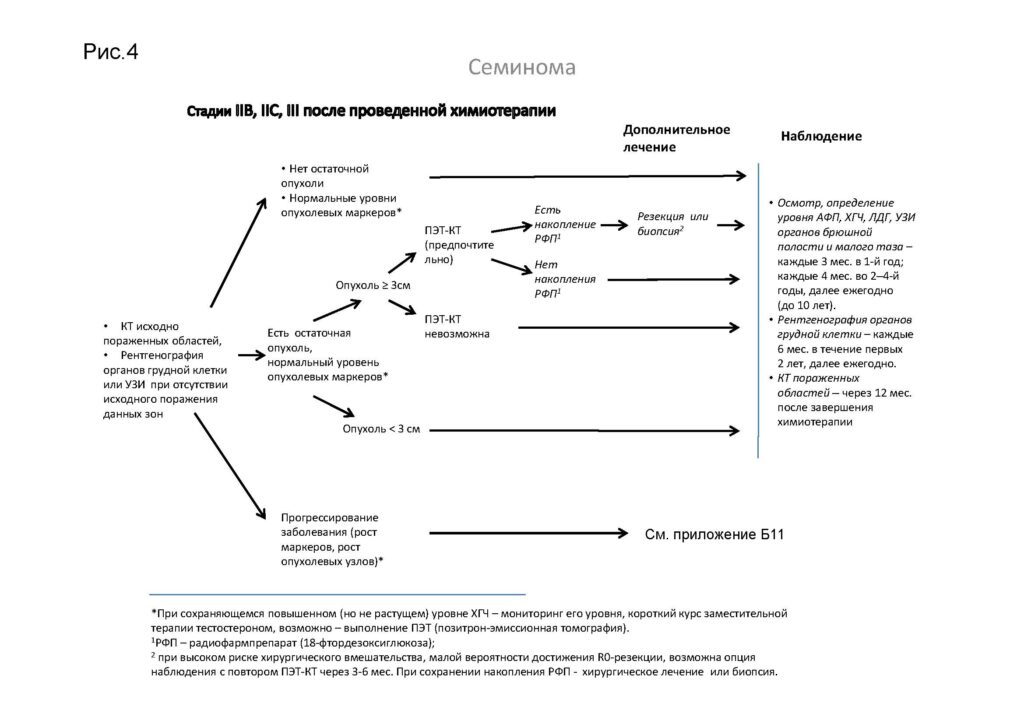
*При сохраняющемся повышенном (но не растущем) уровне ХГЧ – мониторинг его уровня, короткий курс заместительной терапии тестостероном, возможно – выполнение ПЭТ.
1РФП – радиофармпрепарат (18-фтордезоксиглюкоза).
2При высоком риске хирургического вмешательства, малой вероятности достижения R0-резекции, возможна опция наблюдения с повтором ПЭТ-КТ через 3–6 мес. При сохранении накопления РФП – хирургическое лечение или биопсия.
Несеминомные герминогенные опухоли
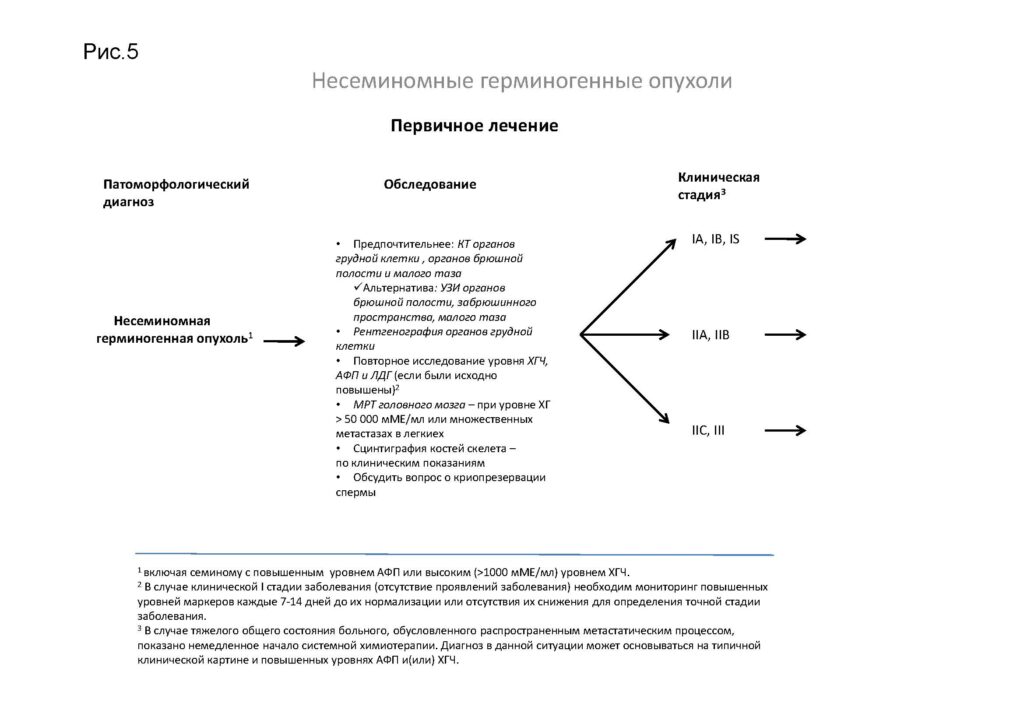
1Включая семиному с повышенным уровнем АФП или высоким (>1000 мМЕ/мл) уровнем ХГЧ.
2В случае клинической I стадии заболевания (отсутствие проявлений заболевания) необходим мониторинг повышенных уровней маркеров каждые 7–14 дней до их нормализации или отсутствия их снижения для определения точной стадии заболевания.
3В случае тяжелого общего состояния пациента, обусловленного распространенным метастатическим процессом, показано немедленное начало системной химиотерапии. Диагноз в данной ситуации может основываться на типичной клинической картине и повышенных уровнях АФП и(или) ХГЧ.
Лечение I стадии несеминомных герминогенных опухолей
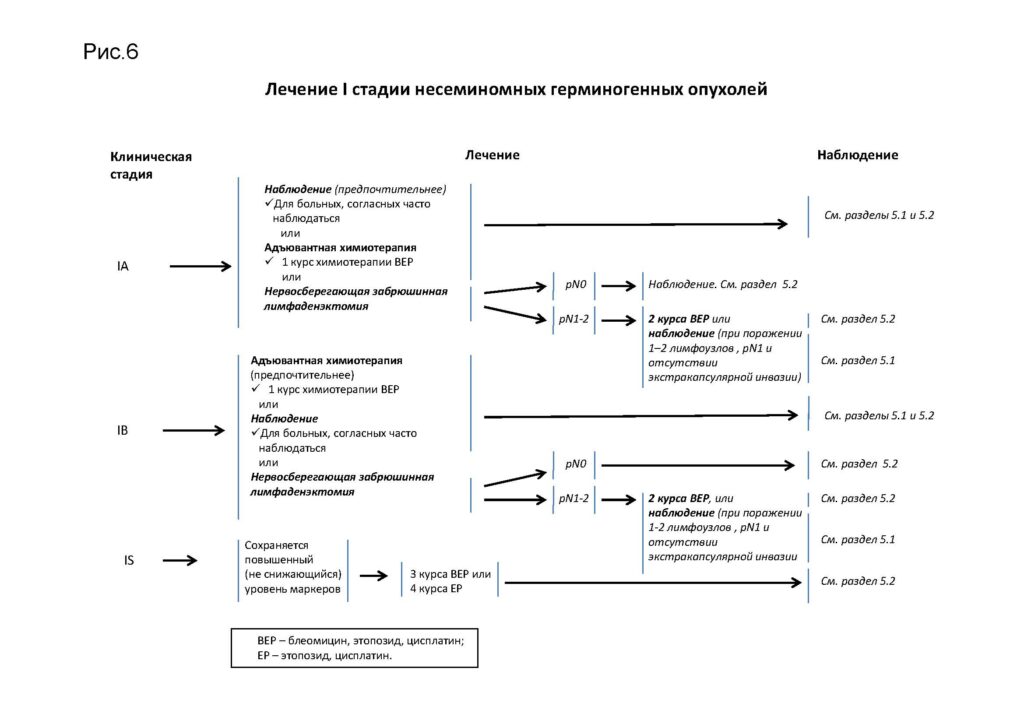
Лечение II A,B стадий несеминомных герминогенных опухолей
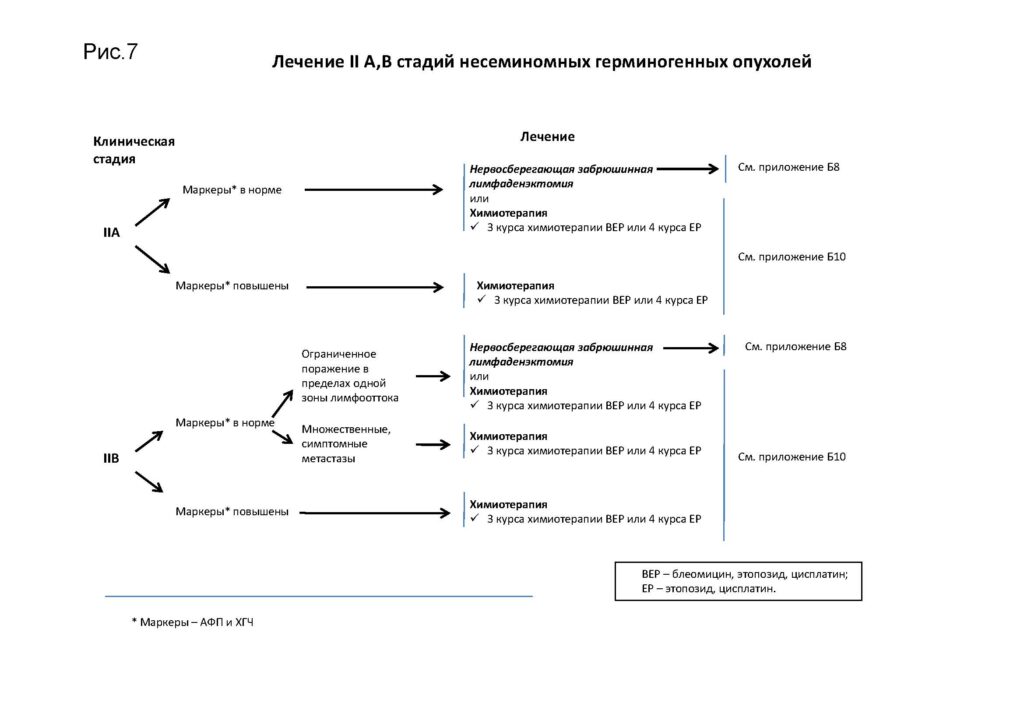
Лечение II A, B стадий после забрюшинной лимфаденэктом при несеминомных герминогенных опухолях
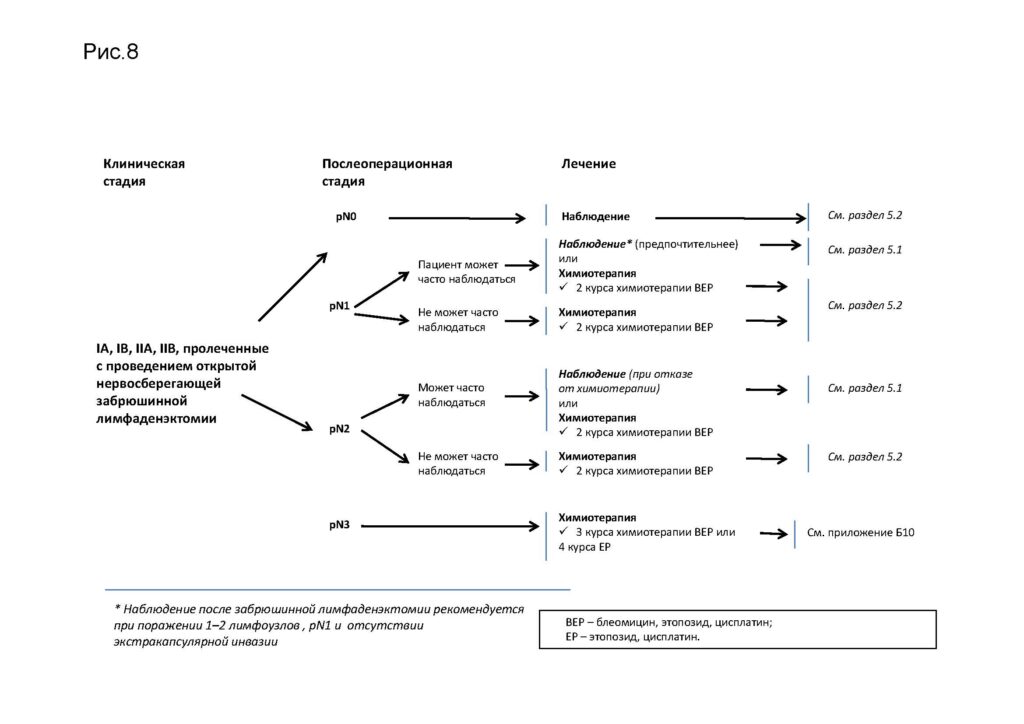
Лечение распространенных несеминомных герминогенных опухолей (II–III стадий)
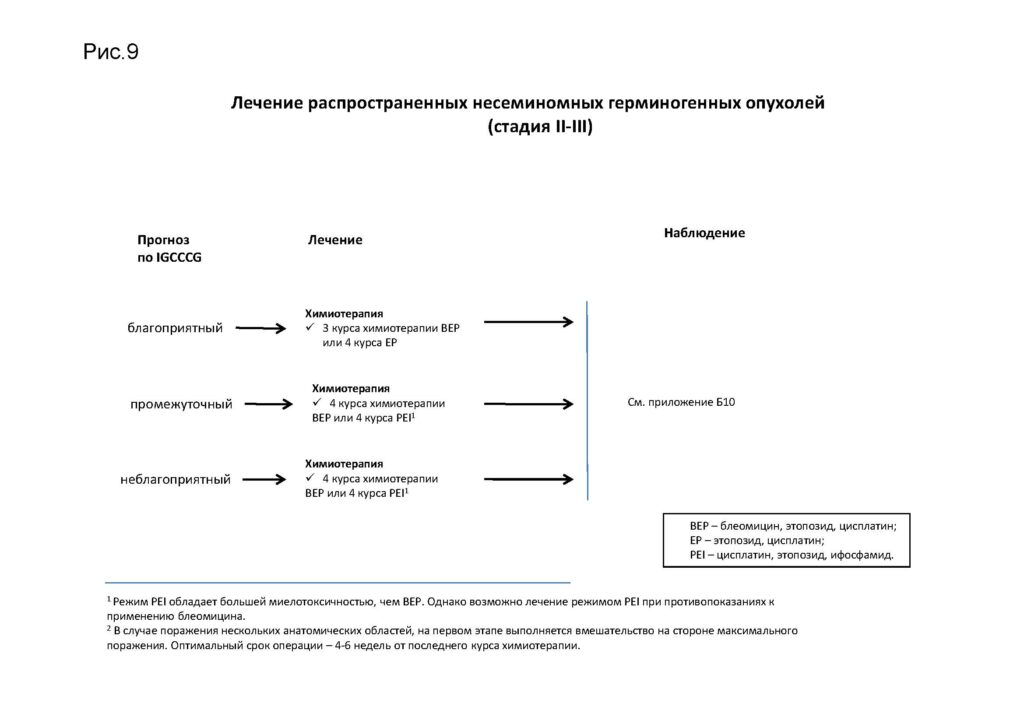
1Режим PEI обладает большей миелотоксичностью, чем ВЕР. Однако возможно лечение режимом PEI при противопоказаниях к применению блеомицина.
2В случае поражения нескольких анатомических областей, на первом этапе выполняется вмешательство на стороне максимального поражения. Оптимальный срок операции – 4–6 нед. после последнего курса химиотерапии.
Лечение после химиотерапии несеминомных герминогенных опухолей
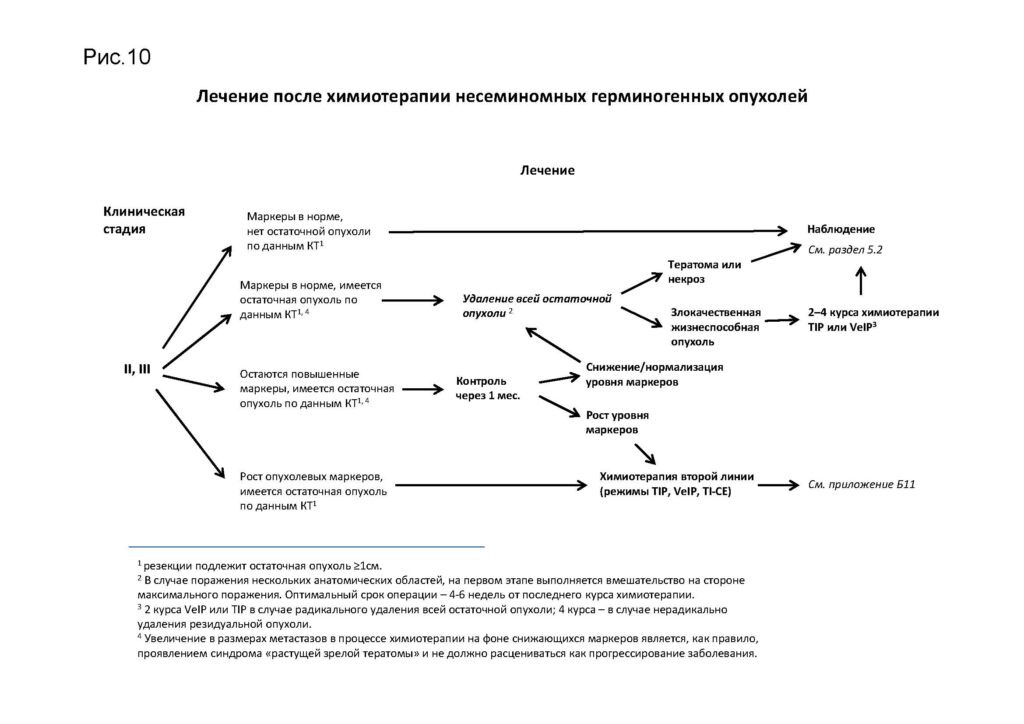
1Резекции подлежит остаточная опухоль ≥1см.
2В случае поражения нескольких анатомических областей, на первом этапе выполняется вмешательство на стороне максимального поражения. Оптимальный срок операции – 4–6 нед. после последнего курса химиотерапии.
32 курса VeIP или TIP в случае радикального удаления всей остаточной опухоли; 4 курса – в случае нерадикального удаления резидуальной опухоли.
4Увеличение в размерах метастазов в процессе химиотерапии на фоне снижающегося уровня маркеров является, как правило, проявлением синдрома растущей зрелой тератомы и не должно расцениваться как прогрессирование заболевания.
Лечение рецидивов герминогенных опухолей
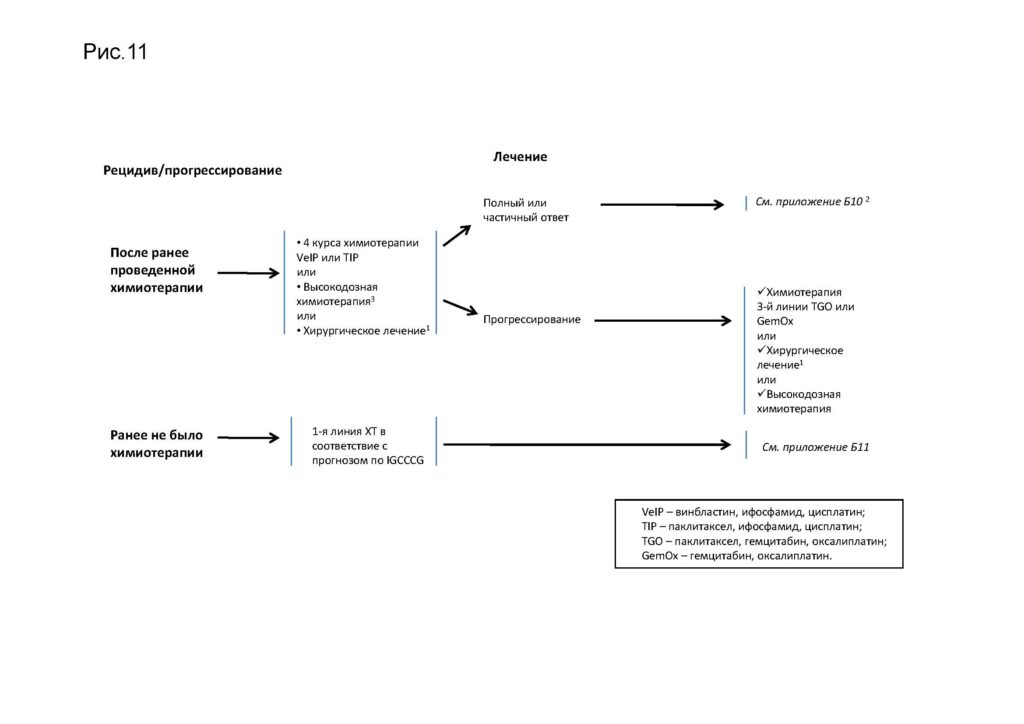
1Хирургическое лечение является методом выбора при поздних рецидивах ввиду их плохой чувствительности к химиотерапии. Также оно возможно и при изолированном поражении одной анатомической области при наличии других «неблагоприятных» факторах.
2Даже при достижении полного эффекта после химиотерапии 2-й линии необходимо рассмотреть вопрос о хирургическом лечении (нервосберегающей забрюшинной лимфаденэктомии в месте ранее расположенного рецидива).
3Отсутствуют убедительные данные о преимуществе высокодозной химиотерапии перед обычной химиотерапией в лечении рецидивов. Высокодозная химиотерапия может использоваться в центрах, имеющих опыт ее применения.
Диагностика и первичное обследование при внегонадных герминогенных опухолях
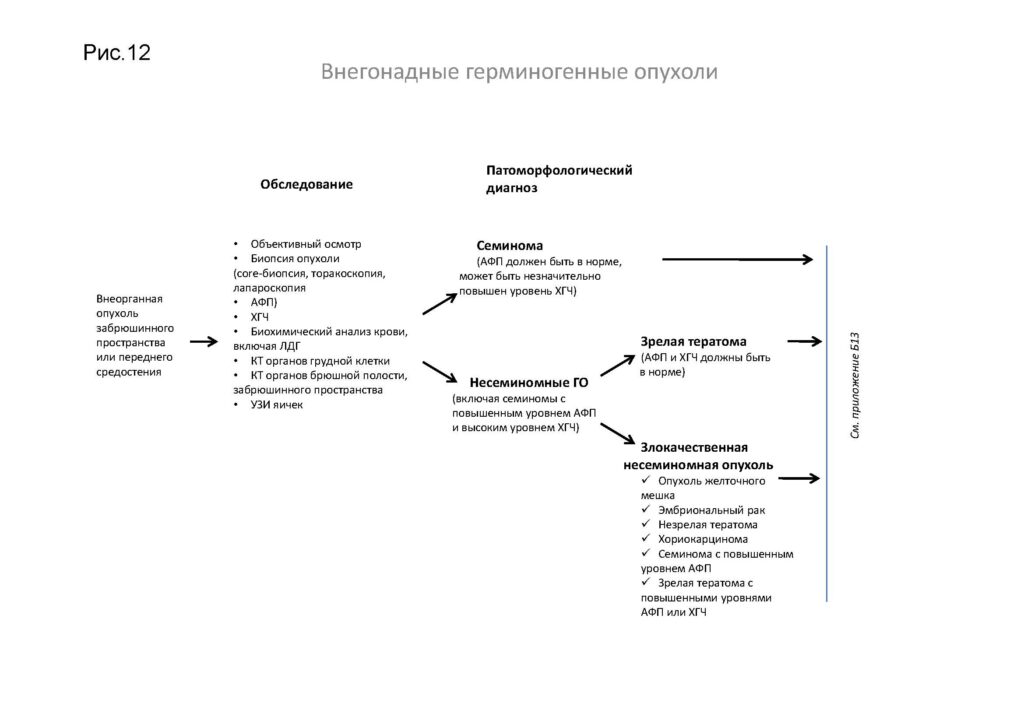
Лечение внегонадных герминогенных опухолей
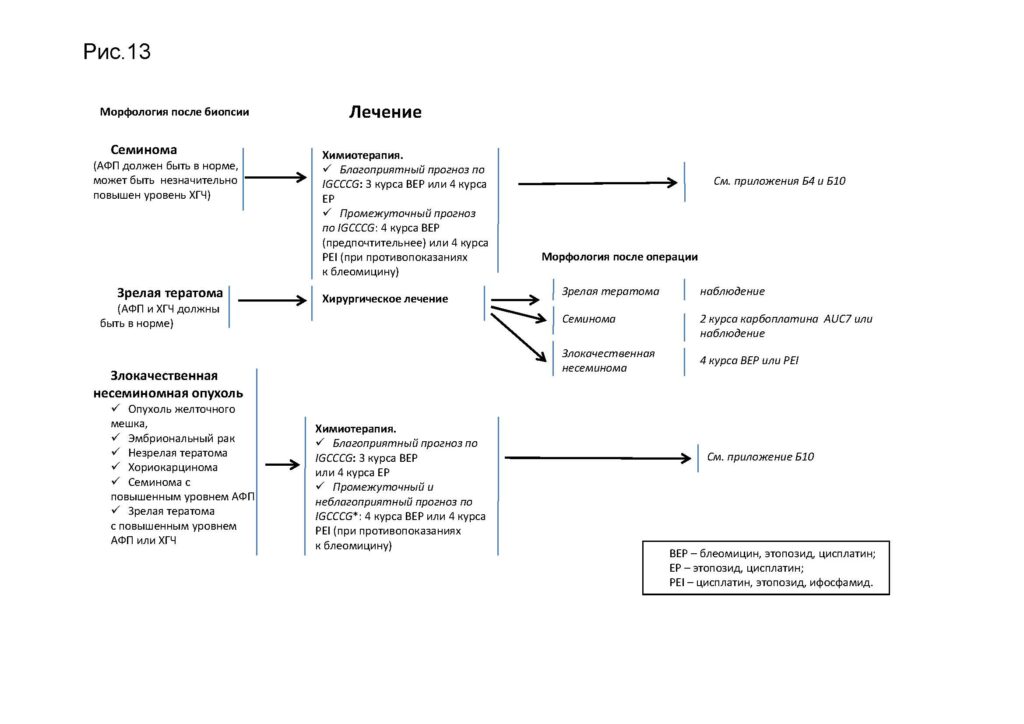
*Внегонадные несеминомные герминогенные опухоли средостения (за исключением зрелой тератомы) в соответствии с классификацией IGCCCG имеют неблагоприятный прогноз независимо от уровня опухолевых маркеров, наличия или отсутствия отдаленных метастазов.
Рекомендация при осложнениях химиотерапии – связаться с врачом-онкологом.
1. При повышении температуры тела до 38°C и выше:
2. При стоматите:
3. При диарее:
4. При тошноте:
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status.
Oken M.M., Creech R.H., Tormey D.C. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5(6):649–55.
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание (шаблон):
| Балл | Описание |
| 0 | Пациент полностью активен, способен выполнять все действия так же, как и до заболевания (90–100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 % по шкале Карновского) |
Примечание. Ключ (интерпретация) приведен в самой шкале.