Одобрено Научно-практическим Советом Минздрава РФ
ᅠ ᅠ
Скачать в PDF ⟶
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:
C65, C66
Возрастная категория:
Взрослые
Год утверждения:
2023
Год окончания действия:⠀
2025
Статус
Действует
Рабочая группа:
Блок по организации медицинской помощи:
Конфликта интересов нет.
Разработчик клинической рекомендации:
БПВ – беспрогрессивная выживаемость
в/в – внутривенно
ВОЗ – Всемирная организация здравоохранения
ИГХ – иммуногистохимический
КТ – компьютерная томография
ЛТ – лучевая терапия
ЛУ ‒ лимфатический(ие) узел(узлы)
МКБ-11 – Международная статистическая классификация болезней и проблем, связанных со здоровьем 11-го пересмотра
МРТ – магнитно-резонансная томография
МСКТ – мультиспиральная компьютерная томография
МСКТУ – мультиспиральная компьютерная томографическая урография
НЯ – нежелательные явления
ОВ – общая выживаемость
РМП – рак мочевого пузыря
РНУ – радикальная нефроуретерэктомия
СЛ – синдром Линча
УР – уротелиальный рак
УРВМП – уротелиальный рак верхних мочевыводящих путей
ХТ – химиотерапия
ЧОО – частота объективных ответов
CIS (англ. carcinoma in situ) – карцинома in situ
ECOG – PS (англ. Eastern Cooperative Oncology Group performance status) – оценка общего состояния онкологического пациента по шкале Восточной объединенной группы онкологов
FISH – флуоресцентная in situ гибридизация
RECIST (англ. Response Evaluation Criteria in Solid Tumors) – критерии ответа солидных опухолей на терапию
iRECIST (англ. Immune-modified Response Evaluation Criteria in Solid Tumors) – критерии иммуноопосредованного ответа солидных опухолей
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат офф-лейбл, не утвержденный государственными регулирующими органами, либо не упомянутый в инструкции по применению, либо применяемый по показанию или по иным параметрам применения (лекарственная форма, режим дозирования, для популяции) способом, не упомянутым в утвержденной инструкции.
Адъювантная химиотерапия – лекарственная терапия, проводимая после выполнения радикальной операции, направленная на уничтожение отдаленных микрометастазов с целью увеличения безрецидивной и общей выживаемости пациентов.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации) в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Неоадъювантная химиотерапия – лекарственная химиотерапия, проводимая непосредственно перед хирургическим удалением первичной опухоли для улучшения результатов операции или лучевой терапии, для предотвращения образования метастазов.
Нефроуретерэктомия – операция по удалению почки и мочеточника целиком (включая интрамуральный отдел мочеточника), в ряде случаев требующая одновременного выполнения резекции мочевого пузыря.
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Предреабилитация (англ. prehabilitation) – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Третий этап реабилитации (период остаточных явлений течения заболевания) – реабилитация в ранний и поздний реабилитационные периоды в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, а также выездными бригадами на дому.
MMR (англ. mismatch repair deficiency) – система репарации ошибочно встроенных неповрежденных неспаренных нуклеотидов.
PD-1 – рецептор программируемой клеточной смерти 1.
PD-L1 – лиганд рецептора программируемой клеточной смерти 1.
По распространенности среди злокачественных опухолей уротелиальный рак (УР) занимает 4-е место после рака предстательной, молочных желез, легкого и колоректального рака [1]. Данный вид опухоли может возникать как в нижних мочевыводящих путях (мочевой пузырь или уретра), так и в верхних (чашечно-лоханочная система почки или мочеточник).
Уротелиальный рак верхних мочевыводящих путей (УРВМП) представляет собой более агрессивный по своей природе вид опухоли: так, 60 % случаев УРВМП на момент установления диагноза представлены инвазивными формами, у 7 % пациентов есть метастазы, в то время как при раке мочевого пузыря (РМП) инвазивные формы встречаются в 15–25 % случаев [2, 3]. Пик заболеваемости приходится на 70–90 лет, при этом УРВМП в 3 раза чаще встречается у мужчин, чем у женщин [4].
Наследственные случаи УРВМП связаны с наследственным неполипозным колоректальным раком [5]. Пациенты с подтвержденным высоким риском развития неполипозного колоректального рака должны пройти секвенирование ДНК, как и члены их семей [6]. У 98 % больных УРВМП, ассоциированным с синдромом Линча (СЛ), по данным иммуногистохимического (ИГХ) анализа, выявляется мутация гена, которая проводит к потере экспрессии белка, отвечающего на предрасположенность к развитию нарушений системы репарации ошибочно встроенных неповрежденных неспаренных нуклеотидов (MMR – mismatch repair deficiency) (у 46 % пациентов отмечалась микросателлитная нестабильность, у 54 % – микросателлитная стабильность) [7]. Большинство опухолей развивалось у носителей мутации гена MSH2 [8].
В настоящее время ряд факторов окружающей среды оказывает влияние на развитие УРВМП [9], однако опубликованные данные, подтверждающие роль этих факторов, недостаточно достоверны, за исключением влияния курения и аристолоховой кислоты.
Курение увеличивает риск развития УРВМП с 2,5 до 7 [10]. Профессиональная деятельность, связанная с определенными ароматическими аминами (лакокрасочная, текстильная, химическая, нефтяная и угольная промышленность), также служит фактором риска [9]. У людей, занятых на таких производствах, реализуется карциногенный эффект определенных химических веществ (бензидин и β-нафталин). Экспозиция составляет около 7 лет (латентный период – до 20 лет). Риск развития УРВМП после контакта с ароматическими аминами повышается в 8 раз [9].
Аристолоховая кислота – нитрофенантренкарбоновая кислота, вырабатываемая растениями рода Aristolochia, оказывает множественное влияние на мочевыводящие пути. Аристолоховая кислота необратимо повреждает проксимальные канальцы почек, что приводит к хроническому тубулоинтерстициальному нефриту, в то время как мутагенные свойства этого химического канцерогена приводят к развитию УРВМП [11, 12]. Аристолоховая кислота также связана с развитием РМП, рака почки, гепатоцеллюлярной карциномы и внутрипеченочной холангиокарциномы [13]. Известны 2 пути попадания аристолоховой кислоты в организм человека: загрязнение сельскохозяйственных продуктов растениями рода Aristolochia (Кирказон) (например, случай балканской эндемической нефропатии [14]) и прием средств на основе этих растений [15, 16]. Травы рода Aristolochia используются во всем мире, особенно в традиционной китайской медицине и в Тайване [12]. У менее чем 10 % людей, подвергшихся воздействию аристолоховой кислоты, развивается УРВМП [11].
Уротелиальный рак чаще всего представлен РМП (90–95 %), гораздо реже встречается УРВМП (5–10 %) [17, 18, 19], в западных странах ежегодная заболеваемость УРВМП составляет почти 2 случая на 100 тыс. населения. За последние несколько десятилетий этот показатель вырос за счет лучшей выявляемости и увеличения выживаемости больных РМП [2]. Опухоли лоханки почки встречаются в 2 раза чаще, чем опухоли мочеточника. Сопутствующая карцинома in situ (carcinoma in situ, CIS) верхних мочевыводящих путей диагностируется с частотой от 11 до 36 % [2]. У 17 % больных УРВМП также выявляют РМП [20]. Рецидив заболевания в мочевом пузыре встречается у 31–50 % пациентов, страдающих УРВМП [21], в то время как рецидив в лоханке с контралатеральной стороны – только в 2–6 % случаев [22].
По МКБ-11 такие опухоли классифицируются в соответствии с органом первичного происхождения новообразования:
Гистологические типы
Более 95 % уротелиальных опухолей развивается из уротелия и относится к УРВМП или РМП. Что касается УРВМП, морфологические варианты описаны как более часто встречаемые при уротелиальных опухолях почки. Эти варианты относятся к опухолям высокого злокачественного потенциала (high-grade) и соответствуют одному из следующих вариантов: микропапиллярному, светлоклеточному, нейроэндокринному или лимфоэпителиальному. Рак собирательных протоков имеет сходные характеристики с УРВМП благодаря общему эмбриональному происхождению.
Опухоли верхних мочевыводящих путей с неуротелиальной морфологической структурой довольно редки. Эпидермоидный рак верхних мочевыводящих путей диагностируется менее чем в 10 % случаев опухолей чашечно-лоханочной системы и еще реже наблюдается при опухолях мочеточника. Другие морфологические типы представлены аденокарциномой (<1 %), нейроэндокринным раком и саркомой.
Классификация
Классификация и морфология УРВМП сходна с таковыми при РМП [17]. Выделяют неинвазивные папиллярные опухоли: папиллярный УР с низким (low-grade) или высоким (high-grade) злокачественным потенциалом, плоские поражения (CIS) и инвазивный рак. Все варианты уротелиальных опухолей, описанные для мочевого пузыря, также могут встречаться в верхних мочевыводящих путях.
TNM-классификация злокачественных опухолей Международного союза по борьбе с онкологическими заболеваниями, 2017 (8-й пересмотр)
Согласно TNM-классификации (от англ. tumor, nodus и metastasis – опухоль, узел, метастазы), в качестве регионарных лимфатических узлов (ЛУ) рассматриваются ЛУ ворот почки, парааортальные, паракавальные и для мочеточника – тазовые ЛУ. Сторона поражения не влияет на N-классификацию.
Стадирование заболевания
Стадирование опухолей лоханки и мочеточника осуществляется в соответствие с классификацией TNM AJCC/UICC (2017) 8-го пересмотра (American Joint Committee on Cancer, AJCC – Американский объединенный комитет по изучению рака, Union Internationale Contre le Cancer, UICC – Международный союз по борьбе с онкологическими заболеваниями).
o Тх – первичная опухоль не может быть оценена;
o Т0 – нет данных, указывающих на наличие первичной опухоли;
o Та – неинвазивный папиллярный рак;
o Tis – CIS;
o Т1 – опухоль вовлекает субэпителиальную соединительную ткань;
o Т2 – опухоль поражает мышечный слой;
o Т3 – (почечная лоханка) опухоль прорастает за пределы мышечной оболочки в перипельвикальную жировую ткань или почечную паренхиму; (мочеточник) опухоль прорастает за пределы мышечного слоя в периуретеральную жировую клетчатку;
o Т4 – опухоль вовлекает соседние органы или прорастает через почку в паранефральную клетчатку.
o Nх – регионарные ЛУ не могут быть оценены;
o N0 – нет метастазов в регионарных ЛУ;
o N0 – без наличия регионарных метастазов;
o N1 – метастаз в 1 ЛУ размером 2 см и менее в наибольшем измерении;
o N2 – метастаз в 1 ЛУ размером более 2 см или несколько метастазов в ЛУ.
o М0 – нет отдаленных метастазов;
o М1 – есть отдаленные метастазы.
Соответствие стадий опухолевого процесса в зависимости от категорий TNM представлено в табл. 1.
Таблица 1. Соответствие стадий опухолевого процесса категориям TNM
| Стадия | Категория | ||
|---|---|---|---|
| Т | N | М | |
| 0is, 0а | Tis, Ta | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| IV | T4 | N0 | M0 |
Диагноз УРВМП может быть установлен на основании симптомов или выявлен случайно. Наиболее распространенный симптом – макро- или микрогематурия, выявляемая в 70–80 % случаев [23, 24].
Критерии установления диагноза/состояния по данным:
Клинический диагноз основан на результатах:
Хирургическое лечение возможно и при отсутствии морфологической верификации: у пациентов с выявленными солидными новообразованиями лоханки, мочеточника или чашечек почки, накапливающими контрастный препарат при оптимальном лучевом исследовании – компьютерная томография (КТ) с контрастированием и/или магнитно-резонансная томография (МРТ) с контрастированием.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: диагноз УРВМП может быть установлен на основании симптомов или выявлен случайно. Наиболее распространенный симптомом – макро- или микрогематурия, выявляемая в 70–80 % случаев [23, 24].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: боль в боку отмечается примерно в 20 % случаев, а пальпируемое образование в области поясницы – примерно у 10 % пациентов [26, 27]. Системные симптомы (включая анорексию, потерю массы тела, недомогание, усталость, лихорадку, ночную потливость или кашель), связанные с УРВМП, должны насторожить и призвать к более тщательному выявлению метастатического процесса, также они связаны с худшим прогнозом [26, 27].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: положительный результат цитологического исследования мочи позволяет заподозрить УРВМП при условии, что цистоскопия не выявила изменений и исключена CIS мочевого пузыря и простатической уретры [17]. При диагностике УРВМП цитологическое исследование обладает меньшей чувствительностью, чем при РМП, даже при high-grade опухолях, и в идеале должно выполняться in situ (т. е. из полости почки). Положительный результат цитологического исследования может помочь в стадировании, поскольку ассоциирован с мышечной инвазией и распространением опухолевого процесса за пределы органа.
Выявление молекулярных нарушений при FISH становится все более и более популярным для скрининга УР, однако результаты пока предварительные. Использование FISH может быть ограничено преобладанием высокодифференцированных рецидивирующих опухолей в популяции пациентов после органосберегающих операций. Следовательно, FISH в настоящее время обладает ограниченной ценностью, в качестве метода контроля УРВМП [29, 30].
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: МСКТУ считается «золотым стандартом» для обследования верхних мочевыводящих путей, заняв место экскреторной урографии (данное исследование должно выполняться при оптимальных условиях, особенно с включением экскреторной фазы, необходимо выполнять сканирование в спиральном режиме (с шагом в 1 мм) до и после ведения контрастного вещества).
Уровень выявления УРВМП считается достаточным для исследований такого типа: чувствительность – 96 %, специфичность – 99 % для полиповидных опухолей размером от 5 до 10 мм [26]. Чувствительность снижается до 89 % для полиповидных опухолей размером менее 5 мм и составляет 40 % для опухолей размером менее 3 мм. При помощи МСКТУ также можно оценить толщину стенки лоханки почки или мочеточника при подозрении на УРВМП. Основной сложностью остается идентификация плоских поражений, которые не определяемы до тех пор, пока не разовьется массивная инфильтрация.
Было показано, что выявление гидронефроза на этапе дооперационного обследования ассоциировано с распространенным патологическим процессом и худшими онкологическими результатами [35]. Наличие увеличенных ЛУ – предиктор неблагоприятного прогноза УРВМП [36].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: допускается заменить МСКТ органов грудной клетки на рентгенографию органов грудной клетки, если оптимальный вариант лучевой диагностики не может быть проведен в течение 4 нед.
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарий: МРТ показана тем пациентам, которым не удается выполнить МСКТУ. Частота выявления УРВМП при МРТ составляет 75 % (введение контрастного вещества для опухолей размером менее 2 см). Однако МРТ с контрастным усилением противопоказана некоторым пациентам со сниженной почечной функцией (клиренс креатинина менее 30 мл/мин) из-за риска развития нефрогенного системного фиброза. МРТ без контрастного усиления считается менее ценной для диагностики УРВМП по сравнению с МСКТУ [39].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарий: уретероскопия – лучший метод для диагностики УРВМП. С помощью гибкого уретероскопа можно макроскопически осмотреть мочеточник и большие чашечки почки в 95 % случаев, оценить вид опухоли, выполнить биопсию, определить степень злокачественности опухоли в 90 % случаев с низким уровнем ложноотрицательных результатов. Также с помощью данного метода можно получить материал для цитологического исследования непосредственно из мочеточника, выполнить ретроградную пиелограмму [41]. Гибкая уретроскопия особенно полезна при диагностике у пациентов, которым планируется органосберегающее лечение, и у пациентов с единственной почкой. Данные о степени злокачественности опухоли при биопсии во время уретероскопии, ипсилатеральном гидронефрозе и результат цитологического исследования мочи могут помочь принять решение о радикальной нефроуретерэктомии (РНУ) или эндоскопическом лечении. Тем не менее, недавние исследования предполагают более высокую частоту внутрипузырного рецидива после РНУ у пациентов, которым выполнили диагностическую уретероскопию до операции [42, 43].
Технические разработки в области гибкой уретероскопиии, использование новых методов визуализации улучшают диагностику плоских повреждений [44]. Узкополосная визуализация NBI (англ. narrow band imaging – узко спектральная визуализация) служит многообещающей методикой, однако эти выводы пока предварительные [45–47].
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций ‒ C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: наследственный УР встречается в недифференцированной когорте пациентов с частотой около 0,5–1 % и относится в основном к проявлениям синдрома Линча (СЛ) – наследственного онкологического синдрома, который обусловлен мутацией в одном из генов системы репарации неспаренных нуклеотидов MMR (англ. mismatch repair deficiency): MLH1, MSH2, MSH6, PMS1, PMS2 или EpCAM. При этом синдроме в порядке убывания по частоте встречаемости описаны колоректальный, эндометриоидный рак, рак яичников, желудка, уротелиальные карциномы различных отделов мочевыделительной системы, рак предстательной железы и некоторые другие типы опухолей. Чаще РМП развивается при мутации в MSH2. На наследственный характер заболевания может указывать молодой возраст пациента, неблагоприятный семейный онкологический анамнез, первично-множественные опухоли, новообразования в других органах-мишенях СЛ в анамнезе пациента. Молекулярно-генетическая диагностика заключается в анализе микросателлитной нестабильности, высокую степень которой (статус MSI-H – high level microsatellite instability – высокая микросателлитная нестабильность) рассматривают как вероятное подтверждение заболевания. Минимальная панель из 5 мононуклеотидных STR-маркеров (англ. short tandem repeats – короткие тандемные повторы), зачастую используемая при колоректальном раке, в опухолях других типов обладает недостаточной чувствительностью. В связи с этим статус MSI-H в уротелиальных карциномах следует определять с помощью ИГХ-анализа и выявления потери экспрессии одного из ключевых участников системы репарации неспаренных оснований: MLH1, MSH2, MSH6 или PMS2 [48]. В случае выявления MSI-H наиболее информативное генетическое исследование – определение герминальной мутации в генах-кандидатах СЛ с помощью высокопроизводительного секвенирования (ВПС, или NGS – next generation sequencing) панели генов MMR. В отдельных случаях РМП может развиваться у носителей герминальных мутаций в генах BRCA1/2, MUTYH, RB1 и некоторых др. Если молодой пациент не удовлетворяет диагностическим критериям СЛ, то ему может быть выполнено ВПС экзома или мультигенной онкологической панели [49].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарий: хирургическое вмешательство через 45 дней и более от момента установления диагноза увеличивает риск прогрессирования заболевания [50].
o с солитарными опухолями менее 1,5 см, имеющими строение папиллярного УР LG и соответствующими категории сТa–T1 собирательной системы почки [25, 51, 52];
o с двухсторонними опухолями лоханки, опухолями собирательной системы единственной почки или единственной функционирующей почки, тяжелой хронической болезнью почек, наследственными синдромами, ассоциированными с высоким риском развития опухолей верхних мочевыводящих путей (прежде всего с СЛ) [25, 51, 52].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: согласно данным систематического обзора литературы, органосохраняющее эндоскопическое хирургическое лечение при УРВМП LG обеспечивает онкологические результаты, сопоставимые с нефруретерэктомией, резекцией мочевого пузыря, позволяя сохранить функцию почки [53]. Выбор метода лечения осуществляется с учетом технических ограничений и опыта хирурга. Для органосохраняющего лечения опухолей лоханки, средней и верхней групп чашечек наиболее удобной методикой служит эндоскопическая электрорезекция/лазерная коагуляция, для адекватного выполнения которой требуется гибкий уретероскоп [52, 54]. Опухоли лоханки и нижней чашечки Ta–Т1 LG, которые невозможно удалить пиелоскопически из-за недостаточного изгиба дистального участка уретеропиелоскопа, могут рассматриваться как показание к перкутанной электрорезекции/аблации. Перкутанный доступ ассоциирован с большим риском диссеминации опухоли по сравнению с эндоскопическим [52, 55].
o при опухолях верхней и средней третей мочеточника сТ >Т1 и/или HG;
o при отсутствии технической возможности выполнения органосохраняющих операций [52].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: частота метастатического поражения регионарных лимфатических узлов при УРВМП зависит от категории Т и злокачественного потенциала (grade) опухоли, составляя 2,2 % при категориях Та–Т1 и 0 % при LG [63, 66]. В случаях, когда адекватное дооперационное стадирование по категории Т и/или оценка злокачественного потенциала (grade) невозможны, решение о лимфодиссекции принимается индивидуально.
Лечебная роль лимфодиссекции у больных УРВМП окончательно не доказана, тем не менее, адекватное стадирование опухолевого процесса при гистологическом исследовании препаратов, полученных во время лимфодиссекции, дает возможность отобрать кандидатов для адъювантного лечения, имеющего доказанную эффективность (см. ниже).
Оптимальные границы лимфодиссекции не определены. Согласно данным единственного исследования, при УР собирательной системы правой почки целесообразно удаление паракавальных лимфатических узлов от ножек диафрагмы до уровня устья нижней брыжеечной артерии, при УР собирательной системы левой почки – парааортальных лимфатических узлов от ножек диафрагмы до уровня устья нижней брыжеечной артерии [68].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
o с солитарными опухолями мочеточника менее 1,5 см, имеющими строение папиллярного УР LG и соответствующим категории сТa–T1 [25, 51, 52];
o с двухсторонними опухолями верхних мочевых путей, опухолями мочеточника единственной почки или единственной функционирующей почки, тяжелой хронической болезнью почек, наследственными синдромами, ассоциированными с высоким риском развития опухолей верхних мочевыводящих путей (прежде всего с СЛ) [25, 51, 52].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
o с УР верхней и средней третей мочеточника Тa–T1 LG, которым невозможно выполнить эндоскопическое хирургическое вмешательство;
o с УР нижней трети мочеточника независимо от категории Т и злокачественного потенциала (grade);
o с опухолями мочеточника тяжелой хронической болезнью почек, наследственными синдромами, ассоциированными с высоким риском развития опухолей верхних мочевыводящих путей (прежде всего с СЛ) [25, 51, 52].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Комментарий: резекция мочеточника должна выполняться в пределах визуально не измененной части органа. При опухолях нижней трети мочеточника обязательно также удаление части стенки мочевого пузыря с мочеточниковым устьем. Метод реконструкции мочеточника выбирается индивидуально, при этом может использоваться анастомоз конец-в-конец, анастомоз культи резецированного мочеточника с мочевым пузырем, вторым мочеточником, операция Боари, замещение дефекта петлей тонкой кишки [70–73].
Радикальная нефруретерэктомия с резекцией устья мочеточника
o с УР верхней и средней третей мочеточника cT >T1 и/или HG;
o с УР мочеточника, которым невозможно выполнить органосохраняющее лечение [52].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарий: РНУ с резекцией устья мочеточника при УР мочеточника выполняется по тем же принципам, которые описаны для рака собирательной системы почки – использование открытого доступа при инвазивных опухолях, профилактика вскрытия просвета мочевых путей во время операции, выполнение резекции мочевого пузыря с устьем мочеточника со стороны поражения [52].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: частота метастатического поражения регионарных лимфатических узлов при УРВМП зависит от категории Т и злокачественного потенциаал (grade) опухоли, составляя 2,2 % при категориях Та–Т1 и 0 % при LG [63, 66]. В случаях, когда адекватное дооперационное стадирование по категории Т и/или оценка злокачественного потенциала (grade) невозможны, решение о лимфодиссекции принимается индивидуально.
Лечебная роль лимфодиссекции у больных УРВМП окончательно не доказана, тем не менее, адекватное стадирование опухолевого процесса при гистологическом исследовании препаратов, полученных во время лимфодиссекции, дает возможность отобрать кандидатов для адъювантного лечения, имеющего доказанную эффективность (см. ниже).
Оптимальные границы лимфодиссекции не определены. Согласно данным единственного исследования, целесообразно удаление лимфатических узлов:
Уровень убедительности рекомендаций – А (уровень достоверности рекомендаций – 1).
– #Митомицин**: 40 мг в 40 мл натрия хлорида** внутрипузырно, перед удалением уретрального катетера, установленного после РНУ, экспозиция – 1–2 часа.
– #Доксорубицин**: 40-50 мг в 25-50 мл 0,9 % раствора натрия хлорида** внутрипузырно, перед удалением уретрального катетера, установленного после РНУ, экспозиция – 1–2 часа.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Комментарии: частота рецидивов УРВМП в мочевом пузыре после хирургического лечения достигает 22–47 %. В 2 рандомизированных исследованиях и метаанализе данных показано, что единичная инстилляция химиопрепарата в мочевой пузырь в течение 2–10 сут после РНУ с резекцией устья мочеточника снижает риск рецидива в течение 1-го года наблюдения. До инстилляции необходимо выполнение цистографии для исключения риска попадания химиопрепарата в брюшную полость [79–81]. Доказательств эффективности метода после органосохраняющего лечения нет, однако с высокой степенью вероятности результаты должны быть аналогичны данным, полученным у пациентов, подвергнутых РНУ с резекцией устья мочеточника.
Уровень убедительности рекомендаций – В (уровень достоверности рекомендаций – 2).
Комментарий: адъювантная внутриполостная антеградная (через нефростому) и ретроградная (через мочеточниковый катетер) БЦЖ-терапия и химиотерапия (ХТ) у больных, подвергнутых органосохраняющему лечению УРВМП изучалась в нескольких небольших исследованиях. Систематический обзор литературы и метаанализ данных показал отсутствие различий частоты рецидивов, прогрессирования, специфической выживаемости и ОВ в зависимости от метода адъювантной внутриполостной терапии (антеградная или ретроградная терапия или их комбинация), а также отсутствие различий частоты рецидивов после наблюдения по сравнению с адъювантной внутриполостной терапией.
Доказательная база, обосновывающая применение периоперационной ХТ у больных УРВМП, крайне скудная.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: по данным нескольких небольших исследований и их метаанализа, неоадъювантная ХТ у больных УРВМП, которым планировалась РНУ с резекцией устья мочеточника, позволяет снизить категорию Т, уменьшить частоту рецидивов и снизить риск смерти на 59 % [83–87]. Однако методологические особенности завершенных исследований обусловливают низкую доказательную ценность полученных результатов и не позволяют рекомендовать неоадъювантную ХТ в качестве стандартного лечебного подхода всем пациентам.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: в завершенных к настоящему времени исследованиях неоадъювантной ХТ у больных УРВМП чаще всего применялись режимы: гемцитабин**, цисплатин**; гемцитабин**, карбоплатин**; метотрексат**, доксорубицин**, цисплатин**, винбластин** [83–87].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: в рандомизированном исследовании III фазы было продемонстрировано, что адъювантная ХТ, основанная на препарате платины (цисплатине** или карбоплатине** при противопоказаниях к цисплатину**) и гемцитабине**, увеличивает специфическую и безметастатическую выживаемость при УРВМП T2–Т4 и/или N+ по сравнению с наблюдением. Данные по ОВ ожидаются [50].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: по данным рандомизированного исследования III фазы CheckMate 275, включавшем 709 радикально оперированных больных УР группы высокого риска прогрессирования (T2-4 и/или N+), в том числе – 21 % больных УРВМП, получавших или не получавших неоадювантную ХТ, адъювантная иммунотерапия #ниволумабом** достоверно увеличивает безрецидивную выживаемость, выживаемость без рецидива за пределами мочевыводящих путей, безметастатическую выживаемость независимо от статуса PD-L1 в опухоли и проведения неоадювантной ХТ. Адъювантная иммунотерапия ассоциирована с благоприятным профилем безопасности и не ухудшает качество жизни пациентов [93–95].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарий: предположительно, адъювантная ЛТ может снизить частоту местных рецидивов после хирургического лечения, однако данные разных исследований противоречивы [96, 97], поэтому метод стандартом не служит и используется в отобранных случаях с/без ХТ.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: данных, подтверждающих роль метастазэктомии у пациентов с распространенным онкологическим процессом, нет. Тем не менее, в исследовании, включавшем больных как УРВМП, так и РМП, продемонстрировано, что удаление метастатических очагов может быть безопасным и онкологически обоснованным у строго отобранных пациентов с предполагаемой большой продолжительностью жизни [98]. В отсутствие данных рандомизированных исследований целесообразность метастазэктомии должна оцениваться на индивидуальной основе.
Схемы химиотерапии и иммунотерапии, применяемые при неоперабельном местно-распространенном и диссеминированном УРВМП, и используемые в данном разделе:
Режимы химиотерапии
o гемцитабин** – 1000 мг/м2 в/в в 1, 8 и 15-й дни;
o #цисплатин** – 70 мг/м2 в/в в 1(2)-й день и гидратация (изотонический раствор натрия хлорида** (≈ 2,5 л) с целью поддержания диуреза более 100 мл/ч в процессе введения #цисплатина** и в последующие 3 ч.
Цикл повторяют каждые 4 нед;
o #гемцитабин** – 1000 мг/м2 в/в в 1 и 8-й дни;
o #карбоплатин** – AUC-4-5 в 1-й день (дозовый режим может быть изменен в зависимости от клинической ситуации – вынужденная редукция или эскалация дозы в пределах AUC-3-6).
Цикл повторяют каждые 3 нед;
o #винбластин** – 3 мг/м2 в/в в 2, 15, 22-й дни;
o #доксорубицин** – 30 мг/м2 в/в в 2-й день;
o #метотрексат** – 30 мг/м2 в/в в 1, 15, 22-й дни;
o #цисплатин** – 70 мг/м2 во 2-й день и гидратация.
Цикл повторяют каждые 4 нед;
o #винбластин** – 3 мг/м2 в/в в 2-й день;
o #доксорубицин** – 30 мг/м2 в/в в 2-й день;
o #метотрексат** – 30 мг/м2 в/в в 1-й день;
o #цисплатин** – 70 мг/м2 в 2-й день и гидратация;
o рчГ-КСФ
Цикл повторяют каждые 2 нед;
Иммуноонкологические препараты (моноклональные антитела)
Оценка эффективности ХТ проводится на основании критериев ответа солидных опухолей на лечение (RECIST 1.1.). Оценка эффективности иммунотерапии проводится на основании критериев иммуноопосредованного ответа солидных опухолей на лечение (iRECIST 1.1.) (приложение Г3).
Первая линия лекарственной терапии
Выбор метода лекарственной терапии осуществляется на основании наличия противопоказаний к назначению цисплатина**, противопоказаний к назначению карбоплатина** и экспрессии PD-L1 в опухолевой ткани.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: противопоказание к назначению цисплатина** – наличие не менее 1 из следующих критериев: соматический статус по классификации ECOG более 1; скорость клубочковой фильтрации (СКФ)– 60 мл/мин/1,73 м2 и менее; снижение слуха – 2-я степень и более; периферическая нейропатия – 2-я степень и более; сердечная недостаточность III класса по классификации Нью-Йоркской кардиологической ассоциации (New York Heart Association) [109].
В рандомизированном исследовании III фазы (n = 405) больные УР IV стадии, не получавшие предшествующей терапии, были рандомизированы на ХТ по схеме GC или M-VAC. Режимы продемонстрировали сопоставимые частоту объективного ответа (ЧОО), время до прогрессирования и 18-месячную ОВ. Наиболее значимые виды токсичности – миелотоксичность, сепсис на фоне фебрильной нейтропении и мукозит. У больных, получавших GC, чаще отмечались тяжелая анемия и тромбоцитопения. В группе, получавшей M-VAC, чаще регистрировались тяжелая фебрильная нейтропения, а также тяжелые мукозиты [108].
Крупное рандомизированное исследование III фазы сравнивало DD-MVAC с поддерживающей терапией гранулоцитарными колониестимулирующими факторами со стандартным MVAC. Показано, что DD-MVAC увеличивал ЧОО, однако не приводил к значимому увеличению медианы ОВ. У пациентов, получавших DD-MVAC c гранулоцитарными колониестимулирующими факторами, наблюдалась меньшая общая токсичность [107].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарий: основанием для регистрации ингибиторов PD-(L)1 для 1-й линии терапии распространенного УР у пациентов с противопоказаниями к цисплатину** послужили исследования II фазы, в которых применялось PD-L1-тестирование опухолевой ткани. В исследовании #пембролизумаба** использовалась комбинированная шкала оценки экспрессии PD-L1 (CPS), учитывающая позитивные клетки опухоли и клетки иммунной системы, инфильтрирующие опухоль [110]; в исследовании атезолизумаба** учитывалось окрашивание только иммунных клеток [104]. Результаты применения данных препаратов при оценке экспрессии по иным шкалам не изучались. В связи с этим для селекции кандидатов для иммунотерапии пембролизумабом** и атезолизумабом** необходимо тестирование с использованием шкал с доказанной предикторной ценностью.
o при гиперэкспрессии PD-L1 10 % и более – монотерапия пембролизумабом** (200 мг (в/в инфузия в течение 30 мин) каждые 3 нед или 400 мг 1 раз в 6 нед) [110];
o при гиперэкспрессии PD-L1 5 % и более – монотерапия атезолизумабом** (840 мг (в/в инфузия каждые 2 нед), или 1200 мг (в/в инфузия каждые 3 нед), или 1680 мг (в/в инфузия каждые 4 нед) [104].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: эффективность и безопасность пембролизумаба** в 1-й линии терапии распространенного УР изучались в рамках многоцентрового исследования II фазы KEYNOTE-052, включавшего 374 больных, имевших противопоказания к терапии цисплатином**. Первичная цель – ЧОО у всех пациентов и больных с гиперэкспрессией PD-L1. Оценка PD-L1-статуса проводилась по CPS. Пограничное значение экспрессии PD-L1 выделено у первых 100 больных и составило 10 %. У всех пациентов ЧОО – 24 %, у больных с экспрессией PD-L1 – 10–38 % и более. Медиана времени до ответа – 2 мес, при медиане наблюдения 5 мес продолжалось 83 % ответов, медиана длительности ответа не достигнута. Наиболее распространенные НЯ 3–4-й степени тяжести, связанные с лечением, – слабость (2 %), повышение уровня сывороточной щелочной фосфатазы (1 %) и снижение мышечной силы (1 %) [110].
Ингибитор PD-L1 атезолизумаб** в 1-й линии терапии распространенного УР у больных с противопоказаниями к терапии цисплатином** изучался в 1 когорте исследования IMvigor210. Статус экспрессии PD-L1 на инфильтрирующих лимфоцитах в микроокружении опухоли определяли как процент позитивных иммунных клеток: IC0 <1 %, IC1 ≥1 % (но <5 %) и IC2/3 ≥5 %. Первичная цель – ЧОО, которая составила 23 % у всех пациентов и достигла 28 % у больных с гиперэкспрессией PD-L1 IC2/3. При медиане наблюдения 17,2 месяца медиана длительности ответа не достигнута. Связанные с лечением НЯ наблюдались у 66 % (3–4-й степени тяжести у 16 %) больных [104].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: рандомизированное исследование II/III фазы EORTC 30986 сравнивало 2 схемы, содержащие карбоплатин** (метотрексат**, карбоплатин**, винбластин** (M-CAVI) и GemCarbo, у пациентов с такими противопоказаниями к цисплатину**, как СКФ менее 60 мл/мин/1,73 м2 и/или соматический статус ECOG 2. Оба режима продемонстрировали противоопухолевую активность: ЧОО составила 42 % для GemCarbo и 30 % – для M-CAVI. Частота тяжелых НЯ достигла 13,6 и 23 % в группах исследования соответственно [112]. На основании этих данных комбинация GemCarbo стала стандартом лечения данной группы пациентов.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: рандомизированное клиническое исследование III фазы JAVELIN Bladder 100 изучало влияние поддерживающей терапии ингибитором PD-L1 авелумабом** после 1-й линии лечения комбинацией препарата платины и гемцитабина** у больных распространенным УР с объективным ответом или стабилизацией опухолевого процесса после 4–6 циклов ХТ. Больных рандомизировали в группу авелумаба** или наилучшей поддерживающей терапии. Авелумаб** значимо увеличивал ОВ с 14,3 до 21,4 месяца (HR: 0,69; 95 % СI: 0,56–0,86; p <0,001). У 47 % больных группы авелумаба** наблюдались НЯ 3-й степени тяжести и более (для сравнения: в группе контроля – 25 % таких пациентов). Иммуноопосредованные НЯ отмечены в 29 % случаев, достигли 3-й степени тяжести и более у 7 % больных и включали колит, пневмонит, сыпь, повышение уровня печеночных ферментов, гипергликемию, миозит и гипотиреоз [113].
o #гемцитабин** – 1000 мг/м2 в/в в 1, 8 дни;
o #цисплатин** – 70 мг/м2 в/в в 1(2)-й день и гидратация (изотонический раствор натрия хлорида** (ок. 2,5 л) с целью поддержания диуреза более 100 мл/ч в процессе введения цисплатина** и в последующие 3 ч).
Цикл повторяют каждые 3 нед;
o #атезолизумаб** – 1200 мг в/в капельно каждые 3 нед.
o #гемцитабин** – 1000 мг/м2 в/в в 1 и 8-й дни;
o #карбоплатин** – AUC-4,5 в 1-й день;
Цикл повторяют каждые 3 нед;
o #атезолизумаб** – 1200 мг в/в капельно каждые 3 нед.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: рандомизированное исследование IMvigor130 сравнивало комбинацию ингибитора PD-L1 атезолизумаба** с ХТ в режимах GC/GemCarbo с ХТ GC/GemCarbo в сочетании с плацебо или монотерапией атезолизумабом. В исследовании достигнута первичная конечная точка: иммунохимиотерапия обеспечивала преимущество беспрогрессивной выживаемости (БПВ) по сравнению с ХТ и плацебо во всей популяции больных (8,2 и 6,3 месяца соответственно; HR: 0,82 (95 % CI: 0,70–0,96); p = 0,007). Незрелые данные по ОВ при медиане наблюдения 11,8 месяца не продемонстрировали различий между группами. Из-за иерархического дизайна тестирования сравнение ХТ с монотерапией атезолизумабом еще не проводилось [114].
o монотерапия пембролизумабом** (200 мг, в/в инфузия в течение 30 мин каждые 3 нед или 400 мг 1 раз в 6 нед) [110];
o монотерапия атезолизумабом** (840 мг в/в инфузии каждые 2 нед, или 1200 мг в/в инфузии каждые 3 нед, или 1680 мг в/в инфузии каждые 4 нед) [104, 172].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: эффективность и безопасность пембролизумаба** в 1-й линии терапии распространенного УР изучались в рамках многоцентрового исследования II фазы KEYNOTE-052, включавшего 374 больных, имевших противопоказания к терапии цисплатином**. У всех больных ЧОО составила 24 %, у пациентов с экспрессией PD-L1 10–38 % и более. Медиана времени до ответа равнялась 2 мес, при медиане наблюдения 5 мес 83 % ответов продолжались, медиана длительности ответа не достигнута. Наиболее распространенными НЯ 3–4-й степени тяжести, связанными с лечением, стали слабость (2 %), повышение уровня сывороточной щелочной фосфатазы (1 %) и снижение мышечной силы (1 %) [110].
Ингибитор PD-L1 атезолизумаб** в 1-й линии терапии распространенного УР у больных с противопоказаниями к терапии цисплатином** изучался в 1 когорте исследования IMvigor210. Первичная цель – ЧОО, которая составила 23 % у всех пациентов. При медиане наблюдения 17,2 мес медиана длительности ответа не достигнута. Связанные с лечением НЯ наблюдались у 66 % (3–4-й степени тяжести – у 16 %) больных [104].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: формальное противопоказание к применению карбоплатина** – выраженное снижение функции костного мозга. Однако в клинической практике у больных распространенным УР в качестве факторов, исключающих возможность назначения карбоплатина**, используются критерии, заимствованные из рандомизированного исследования EORTC 30986 (низкий соматический статус ECOG >2, СКФ <30 мл/мин/1,73 м2 или комбинация соматического статуса ECOG 2 и СКФ <60 мл/мин/1,73 м2), так как прогноз этой популяции пациентов плохой независимо от проведения ХТ на основе препаратов платины или без них [112]. Данные о возможностях лекарственного противоопухолевого лечения у данной группы пациентов ограничены отдельными однорукавными исследованиями, показавшими приемлемую эффективность и безопасность монотерапии таксанами и гемцитабином** [115, 116]. Имеющейся доказательной базы недостаточно для формирования клинических рекомендаций.
Вторая линия лекарственной терапии
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: рандомизированное исследование III фазы KEYNOTE-045 было направлено на сравнение эффективности пембролизумаба** и традиционной ХТ у больных неоперабельным местно-распространенным и диссеминированным УР, прогрессирующим на фоне или в течение 12 мес после завершения ХТ, основанной на цисплатине**. В исследование включено 542 пациента, рандомизированного на терапию пембролизумабом** или монохимиотерапию (паклитаксел**, доцетаксел** или винфлунин). Первичная цель – оценка ОВ и БПВ во всей популяции исследования и у больных с экспрессией PD-L1 10 % и более по CPS. При медиане наблюдения 18,5 месяца пембролизумаб** значимо увеличивал медиану общей выживаемости с 7,4 до 10,3 месяца (HR 0,70; 95 % CI:0,57–0,86; p = 0,0004). Различия беспрогрессивной выживаемости между группами были недостоверны (медиана – 2,1 в группе пембролизумаба** vs 3,3 месяца в группе ХТ, 18-месячная – 16,8 % vs 3,5 % соответственно; р = 0,32). В группе пембролизумаба** ЧОО и частота полного ответа составили 21,1 % и 7,8 % соответственно, в группе ХТ – 11,0 % и 2,9 % соответственно. Медиана длительности ответа на фоне терапии пембролизумабом** не достигнута, на фоне ХТ – 4,4 месяца. Наличие экспрессии PD-L1 (CPS ≥10 %) не оказывало влияния на ЧОО и показатели выживаемости. Иммунотерапия лучше переносилась пациентами: любые НЯ, связанные с лечением, зарегистрированы у 61,3 % больных в группе пембролизумаба** и у 90,2 % пациентов, получавших ХТ; токсичность 3-й степени тяжести и выше зарегистрирована у 16,5 % и 49,8 % больных соответственно [105].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарий: ниволумаб** изучен в качестве монотерапии при диссеминированном УР в исследовании I/II фазы CheckMate 032 у пациентов, получавших не менее 1 предшествующей линии лечения, включавшего препараты платины, независимо от статуса PD-L1. Первичная цель исследования – ЧОО, которая составила 24,4 % и не зависела от уровня экспрессии PD-L1. Связанные с лечением НЯ 3–4-й степени тяжести развились у 22 % пациентов; наиболее частыми из них были повышение сывороточной липазы (5 %) и амилазы (4 %) [117].
В исследовании II фазы Checkmate 275 (n 270) ниволумаб** в 2-й линии терапии резистентного к препаратам платины УР позволил добиться объективного ответа в 19,6 % случаев при медиане времени до лечебного эффекта 1,9 месяца. По мере увеличения уровня экспрессии PD-L1 ЧОО нарастала и составила 28,4 % при положительном окрашивании 5 % клеток и более, а также – 16,1 % у пациентов с экспрессией PD-L1 менее 5 %. Медиана БПВ составила 2 мес (1,87 месяца – при экспрессии PD-L1 менее 1 % и 3,6 месяца – от 1 % и более). Медиана ОВ равнялась 8,74 месяца у всех больных (5,95 месяца – при экспрессии PD-L1 менее 1 % и 11,3 месяца – при экспрессии PD-L1 от 1 % и более). Связанные с лечением НЯ 3–4-й степени тяжести имели место в 18 % наблюдений [95].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: терапия атезолизумабом** при резистентных опухолях изучалась во 2 когорте исследования IMvigor210, включавшей 315 больных распространенным УР, ранее получавших препараты платины. Первичная цель исследования – оценка ЧОО, которая составила 16 % у всех больных и достигла 28 % при PD-L1 IC2/3 [118].
IMvigor211 – рандомизированное исследование III фазы, сравнивавшее эффективность и безопасность атезолизумаба** и ХТ (винфлунин, паклитаксел** или доцетаксел**) у больных диссеминированным УР, в течение или после минимум 1 цитотоксического режима терапии, основанного на препаратах платины (n = 931). Исследование было отрицательным: достоверных различий ОВ всей популяции пациентов, получавших атезолизумаб** или ХТ, не выявлено (медиана – 8,6 vs 8,0 месяца соответственно, HR 0,85; 95 % CI: 0,73–0,99) [119].
В исследовании IIIb фазы SAUL эффективность и безопасность атезолизумаба** изучались у 1004 больных резистентным местно-распространенным или метастатическим уротелиальным или неуротелиальным РМП, включая больных, не соответствующих рутинным критериям включения в клинические исследования, в том числе пациентов, получавших ХТ, основанную не на препаратах платины. Медиана ОВ составила 8,7 месяца, медиана беспрогрессивной выживаемости – 2,2 месяца, ЧОО – 13 %. У 45 % пациентов зарегистрированы НЯ 3-й степени и выше, что привело к прекращению лечения из-за токсичности в 8 % случаев [117].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарий: рандомизированное исследование III фазы (n = 370), сравнивавшее винфлунин с наилучшей поддерживающей терапией при распространенном УР у больных с прогрессированием после проведения ХТ, основанной на цисплатине**. Винфлунин продемонстрировал недостоверное преимущество ОВ во всей популяции пациентов по сравнению с поддерживающим лечением (6,9 vs 4,6 месяца соответственно, HR 0,88; 95 % CI, 0,69–1,12: P = 0,287). Однако при анализе фактических лечебных групп разница результатов в пользу винфлунина оказалась статистически значимой в отношении ОВ (6,9 vs 4,3 соответственно, P = 0,04), а также ЧОО (16 vs 0 %, P = 0,0063), контроля над болезнью (41,1 % vs 24,8 %, P = 0,0024) и медианы БПВ (3,0 vs 1,5 месяца, P = 0,0012). Длительность объективного ответа на терапию винфлунином составила 7,4 месяца (95 % CI 4,5 – 17 мес) [103].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Комментарий: последовательность самостоятельной системной терапии 1 и 2-й линий представлены в табл. 6, 7 (приложение Б).
Принципы обезболивания и оптимального выбора противоболевой терапии больных УРВМП с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендации «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
Принципы профилактики и лечения анемии у пациентов с РМП соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях», размещенным в рубрикаторе клинических рекомендаций Минздрава России https://cr.minzdrav.gov.ru.
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (коллектив авторов: Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. DOI: 10.18027/2224-5057-2018-8-3s2-502-511, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-35.pdf).
Принципы лечения и профилактики костных осложнений у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., Семиглазова Т.Ю. DOI: 10.18027/2224-5057-2018-8-3s2-512-520, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М. DOI: 10.18 027/2224-5057-2018-8-3s2-521-530, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. DOI: 10.18027/2224-5057-2018-8-3s2-531-544, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-38.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов раком с уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А. DOI: 10.18027/2224-5057-2018-8-3s2-545-563, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-39.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов c раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В. DOI: 10.18027/2224-5057-2018-8-3s2-564-574, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf).
Принципы нутритивной поддержки у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10.18027/2224-5057-2018-8-3s2-575-583, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов c раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. DOI: 10.18027/2224-5057-2018-8-3s2-591-603, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-44.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10.18027/2224-5057-2018-8-3s2-604-609, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-45.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов c раком уретры соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (автор: Буйденок Ю.В. DOI: 10.18027/2224-5057-2018-8-3s2-610-616, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf).
К настоящему времени не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть УРВМП или на риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Специфических методов реабилитации не разработано. Следует придерживаться рекомендаций по профилактике хронической почечной недостаточности.
Реабилитация после химиотерапии
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарий: Объем и интенсивность лечебной физкультуры подбирается индивидуально, исходя из степени слабости (легкая, средняя, тяжелая). При улучшении общего состояния интенсивность лечебной физкультуры увеличивается.
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: если выполнялась РНУ, развитие местного рецидива маловероятно, риск возникновения отдаленных метастазов напрямую зависит от факторов риска, которые были упомянуты ранее.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: частота развития рецидива заболевания в мочевом пузыре после лечения первичного УРВМП значительно варьирует от 15 до 50 %. Поэтому обследование мочевого пузыря необходимо проводить во всех случаях. Наличие РМП в анамнезе и мультифокальное поражение УРВМП – факторы риска развития опухоли мочевого пузыря после УРВМП.
Режим наблюдения должен включать цистоскопию и цитологическое исследование мочи, по крайней мере в течение 5 лет. Развитие рецидива заболевания в мочевом пузыре не следует рассматривать как появление отдаленных метастазов.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: в случае проведения органосохраняющего лечения требуется тщательный мониторинг состояния ипсилатеральных мочевыводящих путей ввиду высокого риска развития рецидива. Несмотря на постоянное совершенствование эндоурологической техники, наблюдение за пациентами, пролеченными консервативно, остается сложной задачей и часто требует выполнения миниинвазивных манипуляций.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
После нефроуретерэктомии
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
После органосберегающего лечения
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Диспансерному наблюдению подлежат взрослые с онкологическими заболеваниями, включенными в рубрики С00-D09 МКБ-10.
Диспансерное наблюдение организуется в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете медицинской организации, онкологическом диспансере (онкологической больнице) или иных медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями.
Комментарии: в соответствии с приказом Министерства здравоохранения Российской Федерации от 04 июня 2020 г. № 548н «Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями» для пациентов с уротелиальным раком верхних мочевыводящих путей устанавливается группа диспансерного наблюдения (2-ДН-онко). Категория наблюдаемых пациентов – лица с подтвержденным диагнозом ЗНО. Рекомендуемая периодичность диспансерных приемов пациента врачом (в течение первого года-1 раз в 3 месяца, в течение второго года-1 раз в 6 месяцев, в дальейшем-1 раз в год (если течение заболевания не требует изменения тактики ведения больного).
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи, а при отсутствии в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 3 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет) биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней со дня назначения исследований.
Диагноз онкологического заболевания устанавливается врачом-специалистом на основе результатов диагностических исследований, включающих в том числе проведение цитологической и (или) гистологической верификации диагноза, за исключением случаев, когда взятие биопсийного и (или) пункционного материала не представляется возможным.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения. В случае подтверждения у пациента наличия онкологического заболевания информация об уточненном диагнозе направляется из онкологического диспансера или организации субъекта Российской Федерации, исполняющей функции регистрации пациентов с впервые выявленном злокачественным новообразованием, в медицинскую организацию, осуществляющую диспансерное наблюдение пациента
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи. (Пункт 5: для получения специализированной медицинской помощи в плановой форме выбор федеральной медицинской организации осуществляется по направлению лечащего врача.) В случае если в реализации Программы принимают участие несколько федеральных медицинских организаций, оказывающих специализированную медицинскую помощь при заболеваниях, состояниях (группе заболеваний, состояний), соответствующих заболеваниям, состояниям (группе заболеваний, состояний) пациента, лечащий врач обязан проинформировать пациента (законного представителя пациента) о возможности выбора федеральной медицинской организации, в том числе о возможных сроках ожидания специализированной медицинской помощи, которые могут превышать сроки ожидания, установленные программой государственных гарантий бесплатного оказания гражданам медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения онкологического заболевания (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.), требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, а также проведение эндоскопических исследований при невозможности выполнить их амбулаторно, требуют последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
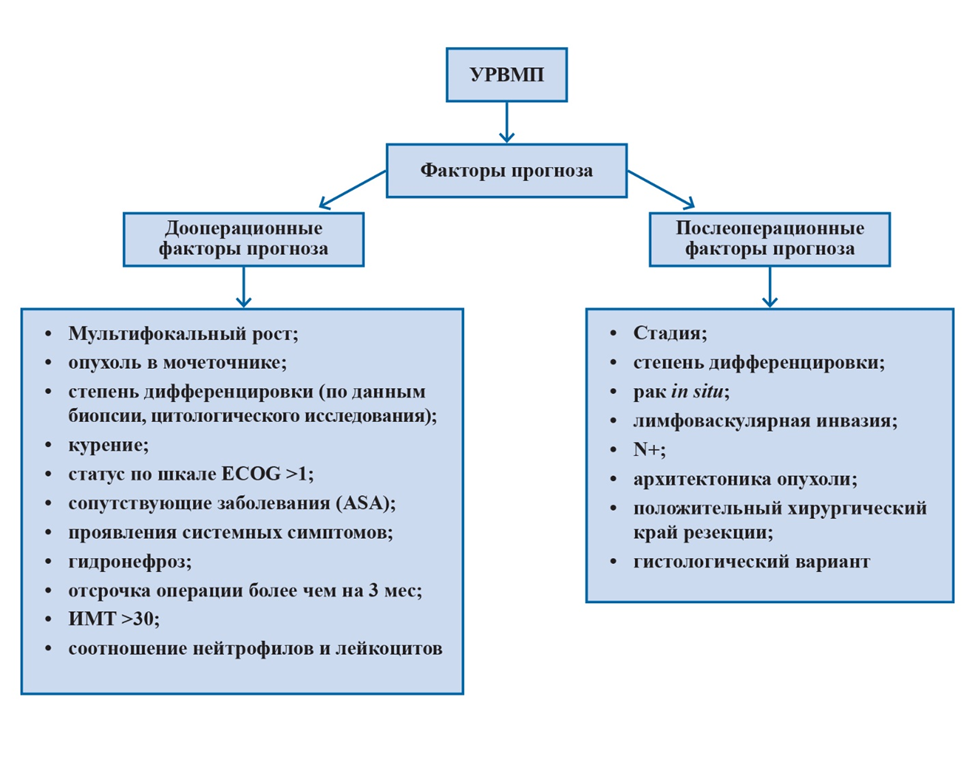
Прогностические факторы
Уротелиальный рак верхних мочевыводящих путей с вовлечением мышечного слоя стенки характеризуется плохим прогнозом. Пятилетняя специфическая выживаемость составляет менее 50 % при рТ2–3 и менее 10 % при рТ4. В данном разделе кратко описаны современные факторы прогноза [17].
В соответствии с большинством классификаций первичные прогностические факторы – стадия опухолевого процесса и степень злокачественности опухолевых клеток.
Раса
В многоцентровом исследовании не вывлены различия в результатах между пациентами разных рас [145], но популяционные исследования показали, что у афроамериканцев результаты хуже, чем в других этнических группах. Также выявили различия между китайскими и американскими пациентами [146].
Метастазы в лимфатических узлах
Метастазы в ЛУ и экстранодальная инвазия – значимые предикторы выживаемости при УРВМП [63]. Лимфаденэктомия, выполняемая во время РНУ, позволяет установить стадию опухолевого процесса, но ее лечебная роль остается дискутабельной [64, 65].
Возраст и пол
Влияние пола на смертность от УРВМП недавно оспорено и более не рассматривается в качестве независимого фактора прогноза. Напротив, возраст пациента до сих пор считается независимым прогностическим фактором, поскольку старший возраст на момент выполнения РНУ ассоциирован с уменьшением опухолевоспецифической выживаемости. Однако пожилой возраст сам по себе не может быть ограничением к агрессивному лечению УРВМП. Большинству пожилых пациентов может быть выполнена РНУ. Это подтверждает тот факт, что возраст сам по себе служит неадекватным критерием при оценке отдаленных результатов у пожилых больных УРВМП.
Курение
Курение на момент постановки диагноза увеличивает риск рецидива заболевания и смертности после РНУ [147, 148] и рецидива в мочевом пузыре. Существует тесная связь между курением и прогнозом. Отказ от курения улучшает контроль над заболеванием.
Хирургическая задержка
Задержка между диагностикой инвазивной опухоли и ее удалением может увеличить риск прогрессирования заболевания. Как только решение о проведении РНУ принято, операцию следует выполнить в течение 12 нед, как только это будет возможно [149–152].
Расположение опухоли
В соответствии с последними данными первичное расположение опухоли в пределах верхних мочевыводящих путей (т. е. мочеточник или лоханка почки) более не рассматривается как прогностический фактор. Это означает, что расположение опухоли (мочеточник или чашечно-лоханочная система почки) больше не влияет на установление стадии опухолевого процесса.
Лимфоваскулярная инвазия
Лимфоваскулярная инвазия встречается примерно в 20 % случаев УРВМП и служит независимым предиктором выживаемости. Сведения о наличии или отсутствии лимфоваскулярной инвазии должны быть включены в гистологическое заключение после РНУ. Однако только у пациентов без метастазов в ЛУ лимфоваскулярная инвазия обладает прогностической ценностью.
Некроз опухоли
Распространенный некроз опухоли служит независимым предиктором клинических результатов для пациентов, которые подверглись РНУ. Распространенным некроз считается при 10 % и более некроза в опухоли.
Гистологический вариант
Строение опухоли (папиллярная или на широком основании) при УРВМП ассоциировано с прогнозом после РНУ. Опухоли на широком основании ассоциированы с худшим прогнозом Наличие сопутствующей CIS у больных УРВМП, не распространяющейся за пределы органа, ассоциировано с высоким риском рецидива заболевания и опухолево-специфической смертностью Как и при УР нижних мочевыводящих путей, наличие CIS служит независимым предиктором худшего прогноза.
Молекулярные маркеры
В ряде исследований изучалось прогностическое влияние молекулярных маркеров, связанных с клеточной адгезией (E-кадгерин [153] и CD24), дифференцировкой клеток (рецептор эпидермального фактора роста человека HER-2 [2]), ангиогенезом (индуцируемый гипоксией фактор 1α и металлопротеиназы), пролиферацией клеток (Ki-67), эпителиально-мезенхимальным переходом, митозом (Aurora A), апоптозом (Bcl-2 и сурвивин), сосудистой инвазией и белком С-met (MET) [147, 154]. Микросателлитная нестабильность служит независимым молекулярным прогностическим маркером [155]. Типирование нестабильности микросателлитов может помочь обнаружить наследственные мутации и наследственный рак [5]. У больных низкодифференцированным УРВМП высока прогностическая ценность экспрессии PD-1 и PDL-1 [156]. Из-за низкой встречаемости УРВМП основные ограничения молекулярных исследований – их ретроспективный дизайн, а также для большинства исследований – небольшой размер выборки. Ни один из маркеров еще не соответствовал критериям, необходимым для поддержки их внедрения в ежедневную клиническую практику.
Рецидив рака мочевого пузыря
В метаанализе выявили значимые факторы прогноза рецидива УРВМП в мочевом пузыре после РНУ [53]. Выделяют 3 категории предикторов высокого риска рецидива в мочевом пузыре:
1) специфические для пациента факторы, такие как мужской пол, РМП в анамнезе, курение и предоперационная хроническая болезнь почек;
2) опухолеспецифические факторы, такие как положительный предоперационный цитологический анализ мочи, локализация опухоли в мочеточнике, мультифокальность, инвазивная стадия pT и некроз;
3) факторы, специфичные для лечения, такие как лапароскопический доступ, экстравезикальное удаление устья мочевого пузыря и положительный хирургический край резекции [53].
Кроме того, использование диагностической уретероскопии было связано с более высоким риском развития рецидива мочевого пузыря после РНУ [42, 43].
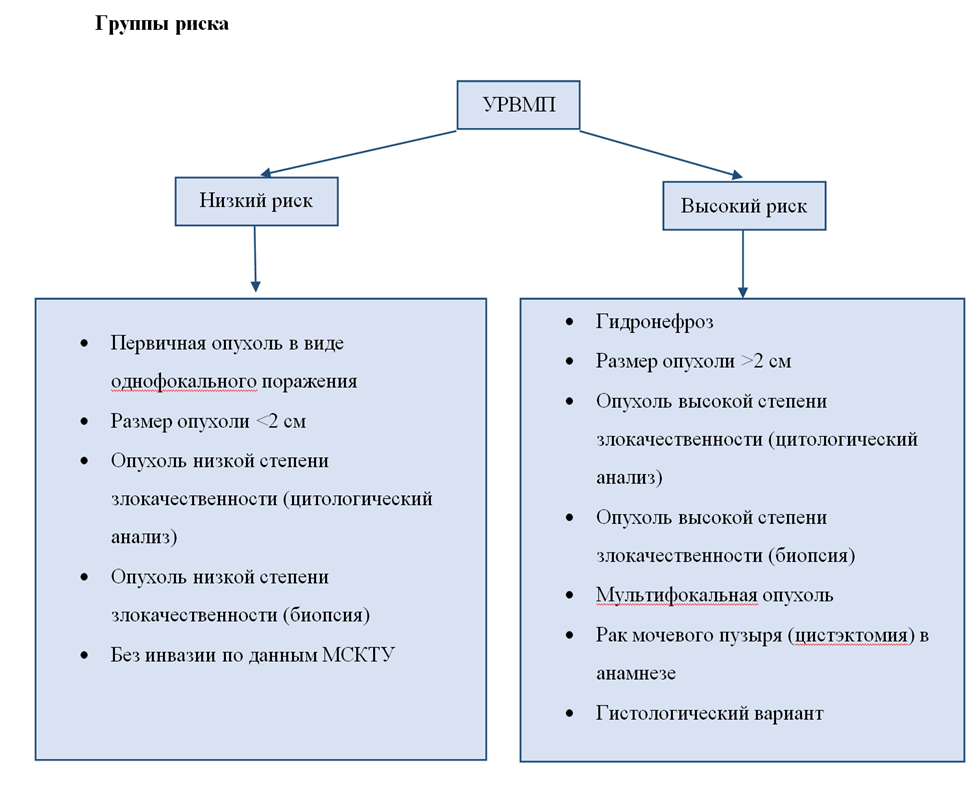
| № п/п | Критерий качества | Оценка выполнения |
|---|---|---|
| 1 | Выполнена КТ забрюшинного пространства, брюшной полости, органов малого таза c контрастным усилением или МРТ забрюшинного пространства, брюшной полости, органов малого таза c контрастным усилением (при установлении диагноза) | Да/Нет |
| 2 | Выполнена цистоскопия, уретероскопия с биопсией (при установлении диагноза) | Да/Нет |
| 3 | Выполнена КТ органов грудной клетки с контрастным усилением (при установлении диагноза) | Да/Нет |
| 4 | Выполнено PD-L1-тестирование перед проведением системной иммунотерапии (при установлении диагноза) | Да/Нет |
| 5 | Выполнено морфологическое и/или ИГХ-исследование препаратов удаленных тканей (при хирургическом вмешательстве) | Да/Нет |
| 6 | Выполнена ХТ и/или иммунотерапия при наличии морфологической верификации диагноза (при ХТ и/или иммунотерапии) | Да/Нет |
Блок по организации медицинской помощи
Конфликта интересов нет.
Целевая аудитория клинических рекомендаций по уротелиальному раку верхних мочевыводящих путей:
Таблица 3. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
| Уровень достоверности доказательств | Расшифровка |
|---|---|
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 4. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| Уровень достоверности доказательств | Расшифровка |
|---|---|
| 1 | Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 5. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| Уровень убедительности рекомендаций | Расшифровка |
|---|---|
| A | Сильная рекомендация:все рассматриваемые критерии эффективности (исходы) важные, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам согласованные |
| B | Условная рекомендация:не все рассматриваемые критерии эффективности (исходы) важные, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не согласованные |
| C | Слабая рекомендация:отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) неважные, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не согласованные |
Порядок обновления клинических рекомендаций. Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию: не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов.
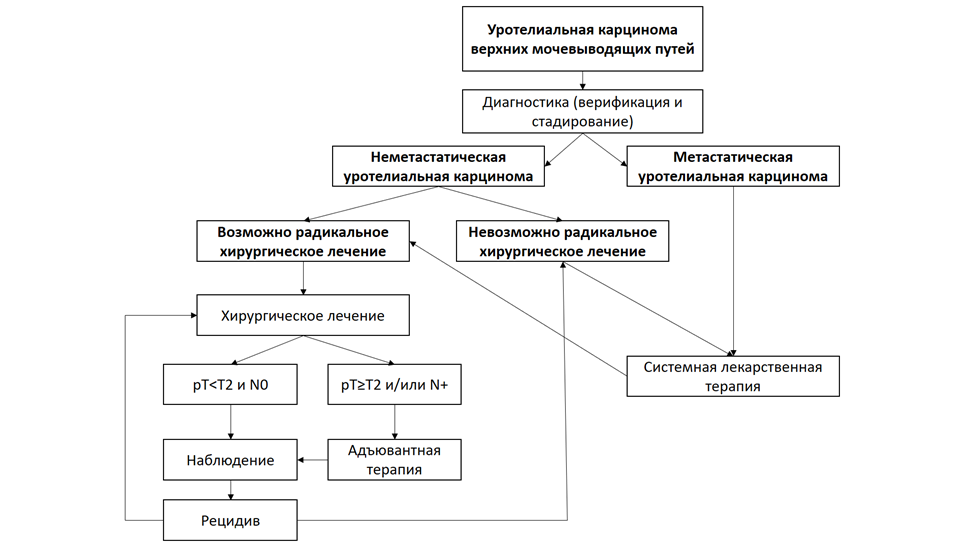
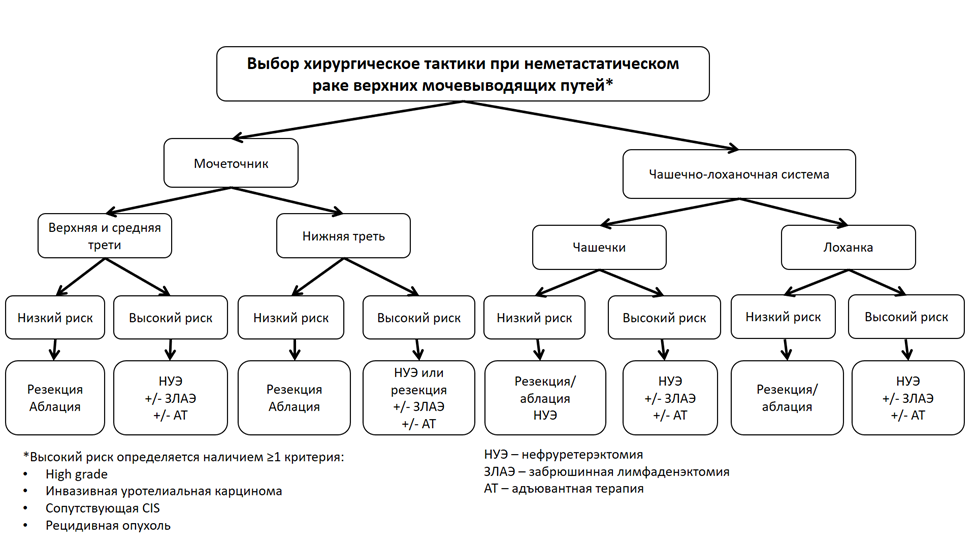
Самостоятельная системная терапия
Таблица №6: Первая линия системной противоопухолевой терапии
| Группа | Режим предпочтения | Альтернативный режим |
|---|---|---|
| Нет противопоказаний к цисплатину1 | GCMVACddMVAC | GC+атезолизумаб |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L- | GarboGem | GarboGem +атезолизумаб |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L+ | GarboGem Атезолизумаб*#Пембролизумаб** | GarboGem +атезолизумаб |
| Есть противопоказания к препаратам платины | ДоцетакселПаклитакселГемцитабин | Атезолизумаб*#Пембролизумаб** |
| При контроле над опухолью после 4-6 циклов ХТ, основанной на препарате платины | Авелумаб |
1 ECOGPS> 1; CКФ ≤ 60 мл/мин/1,73 м2; снижение слуха ≥ 2 степени; периферическая нейропатия ≥ 2 степени; СН класса IIINYHA.
2 Критерии РКИ EORTC 30986 (PSECOG>2; СКФ <30 мл/мин/1,73 м2; ECOGPS 2 и СКФ <60 мл/мин/1,73 м2).
*Для атезолизумаба положительной является экспрессия ≥5% (VentanaPD-L1 (SP142) Assay® (VentanaMedicalSystems, Inc.))
**Для пембролизумаба положительной является экспрессия ≥10% (тест-система DakoPD-L1 IHC 22C3 PharmDxAssay (DakoNorthAmerica, Inc.))
| Группа | Режим предпочтения | Альтернативный режим |
|---|---|---|
| Нет противопоказаний к цисплатину1 | GCMVACddMVAC | GC + #атезолизумаб** |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L- | GarboGem | GarboGem + #атезолизумаб** |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L+ | GarboGem Атезолизумаб**3Пембролизумаб**4 | GarboGem + #атезолизумаб** |
| Есть противопоказания к препаратам платины | #Доцетаксел**#Паклитаксел**#Гемцитабин** | Атезолизумаб**Пембролизумаб** |
| При контроле над опухолью после 4-6 циклов ХТ, основанной на препарате платины | Авелумаб** | — |
1 ECOGPS> 1; CКФ ≤ 60 мл/мин/1,73 м2; снижение слуха ≥ 2 степени; периферическая нейропатия ≥ 2 степени; СН класса IIINYHA.
2 Критерии РКИ EORTC 30986 (PSECOG>2; СКФ <30 мл/мин/1,73 м2; ECOGPS 2 и СКФ <60 мл/мин/1,73 м2).
3 Для атезолизумаба положительной является экспрессия ≥5% (VentanaPD-L1 (SP142) Assay® (VentanaMedicalSystems, Inc.))
4 Для пембролизумаба положительной является экспрессия ≥10% (тест-система DakoPD-L1 IHC 22C3 PharmDxAssay (DakoNorthAmerica, Inc.))
Таблица №7: Вторая линия системной противоопухолевой терапии
| Лечение 1 линии | Режим предпочтения | Альтернативный режим |
|---|---|---|
| Химиотерапия, основанная на препаратах платины | Пембролизумаб** | Атезолизумаб**Ниволумаб**Винфлунин#Паклитаксел**#Доцетаксел** |
| Химиотерапия, основанная не на препаратах платины | Атезолизумаб** | Винфлунин |
| Иммунотерапия ингибиторами иммунных контрольных точек | Режимы химиотерапии, не использованные ранее или использованные за 12 и более месяцев до прогрессирования, с достигнутым эффектом или стабилизацией |
Рекомендации при осложнениях ХТ – связаться с врачом-онкологом (специалистом по химиотерапии).
При повышении температуры тела до 38 °C и выше начать прием антибиотиков по рекомендации врача-онколога (специалиста по ХТ).
При стоматите показано:
При диарее показано:
o исключить жирное, острое, копченое, сладкое, молочное, клетчатку;
o можно нежирное мясо, мучное, кисломолочное, рисовый отвар;
o обильное питье;
При тошноте – принимать препараты по рекомендации врача-онколога (специалиста по ХТ).
Название на русском языке: шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: World Health Organization/The Eastern Cooperative Oncology Group performance status (WHO/ECOG – PS).
Источники (официальный сайт разработчиков, публикация с валидацией):
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т. д.).
Таблица 8. Содержание (шаблон)
| Балл | Описание | Оценка по шкале Карновского1, % |
|---|---|---|
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания | 90–100 |
| 1 | Пациент не способен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) | 70–80 |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении | 50–60 |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования | 30–40 |
| 4 | Пациент с инвалидностью, совершенно не способен к самообслуживанию, прикован к креслу или постели | 10–20 |
| 5 | Пациент мертв |
1 См. приложение Г2. Шкала Карновского.
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: шкала Карновского.
Оригинальное название: Karnofsky Performance Status Scale.
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Ed. by C. MacLeod. New York: Columbia University Press, 1949. Pp. 191–205.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т. д.).
Таблица 9. Содержание (шаблон)
| Балл | Описание |
|---|---|
| 100 | Состояние нормальное, жалоб нет |
| 90 | Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 | Нормальная активность с усилием, незначительные симптомы или признаки заболевания |
| 70 | Обсуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 | Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей |
| 50 | Нуждается в значительной помощи и медицинском обслуживании |
| 40 | Пациент с инвалидностью, нуждается в специальной помощи, в том числе медицинской |
| 30 | Тяжелая инвалидность. Показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 | Тяжелый пациент. Необходимы госпитализация и активное лечение |
| 10 | Умирающий |
| 0 | Смерть |
Ключ (интерпретация): приведен в самой шкале.
Критерии оценки ответа опухоли на лечение RECIST 1.1
Название на русском языке: критерии оценки ответа опухоли на ХТ-лечение (RECIST 1.1).
Оригинальное название: Response Evaluation Criteria In Solid Tumors 1.1.
Источник (официальный сайт разработчиков, публикация с валидацией): Eisenhauer E.A., Therasse P., Bogaerts J. et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). Eur J Cancer 2009;45(2):228–47. DOI: 10.1016/j.ejca.2008.10.026.
Тип: шкала оценки.
Назначение: оценка ответа на ХТ-лечение.
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения г. Москвы» и доступны на сайте: https://tele-med.ai/biblioteka-dokumentov/metodicheskie-rekomendacii-po-primeneniyu-kriteriev-otveta-solidnyh-opuholej-na-himioterapevticheskoe-lechenie-recist-11. Данный документ – собственность Департамента здравоохранения г. Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
Критерии оценки иммуноопосредованного ответа солидных опухолей iRECIST
Название на русском языке: критерии оценки иммуноопосредованного ответа солидных опухолей.
Оригинальное название: Immune-Related Response Evaluation Criteria In Solid Tumors (iRECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Seymour L., Bogaerts J., Perrone A. et al. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol 2017;18(3):e143–52. DOI: 10.1016/S1470-2045(17)30074-8.
Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на иммунотерапию.
Таблица 10. Содержание (шаблон)
| Ответ на лечение | iRECIST |
|---|---|
| Полный ответ | Отсутствие всех целевых образований или лимфатических узлов размером 10 мм и более по короткой оси |
| Частичный ответ | Уменьшение сумм наибольших диаметров целевых очагов на 30 % и более |
| Прогрессирование | Увеличение сумм наибольших диаметров целевых очагов на 20 % и более с абсолютным приростом 5 мм и более. Появление новых очагов не служит признаком прогрессирования; диаметры новых очагов прибавляются к общей сумме таргетных очагов; окончательная оценка ответа опухоли требует подтверждения через 4 нед |
| Стабилизация | Ничего из перечисленного |
Ключ (интерпретация): приведен в самой шкале.