ᅠ ᅠ
Скачать в PDF ⟶
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:
C64
Возрастная категория:
Взрослые
Год утверждения:
2023
Пересмотр не позднее:
2025
Статус
Действует
Состав рабочей группы по разработке и пересмотру:
Блок по организации медицинской помощи:
Конфликта интересов нет. Все члены рабочей группы подтвердили отсутствие конфликта интересов/финансовой поддержки, о которых необходимо сообщить.
Разработчик клинической рекомендации:
Список сокращений
Термины и определения
АГ ‒ артериальная гипертензия
БПВ – беспрогрессивная выживаемость
БРВ – безрецидивная выживаемость
в/в – внутривенный
ВОЗ – Всемирная организация здравоохранения
ДИ – доверительный интервал
ИФН-α ‒ интерферон альфа 2b**
КТ ‒ компьютерная томография
ЛУ ‒ лимфатические(ий) узлы(узел)
МКБ-10 ‒ Международная классификация болезней 10-го пересмотра
мПКР – метастатический почечно-клеточный рак
МРТ ‒ магнитно-резонансная томография
НПВ – нижняя полая вена
нПКР – несветлоклеточный почечно-клеточный рак
НЯ – нежелательные явления
ОВ – общая выживаемость
ОР – отношение рисков
ОШ – отношение шансов
ПКР ‒ почечно-клеточный рак
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронная эмиссионная томография, совмещенная с компьютерной томографией
РН – радикальная нефрэктомия
РП – резекция почки
РФП – радиофармпрепарат
РЧА – радиочастотная аблация почки
СВ – специфическая выживаемость
сПКР – светлоклеточный почечно-клеточный рак
СТЛТ – стереотаксическая лучевая терапия
УЗИ ‒ ультразвуковое исследование
цНЭ – циторедуктивная нефрэктомия
ЧОО – частота объективных ответов
ЭхоКГ − эхокардиография
ECOG PS (англ. Eastern Cooperative Oncology Group performance status) – оценка общего состояния онкологического пациента по шкале, разработанной Восточной объединенной группой онкологов
MLPA (англ. multiplex ligation-dependent probe amplification) – мультиплексная амплификация лигированных зондов
MSKCC (англ. Memorial Sloan–Kettering Cancer Center) – Мемориальный онкологический центр им. Слоуна‒Кеттеринга
mTOR (англ. mammalian target of rapamycin) – мишень рапамицина млекопитающих
RECIST (англ. Response Evaluation Criteria In Solid Tumors) – критерии ответа солидных опухолей на терапию
TKI (англ. tyrosine kinase inhibitors) – ингибиторы тирозинкиназы
VEGF (англ. vascular endothelial growth factor) – фактор роста эндотелия сосудов
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (англ. off-label, офф-лейбл)
Адъювантная химиотерапия – вид химиотерапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
Блокатор CTLA4 – моноклональное антитело, блокирующее антиген цитотоксических Т-лимфоцитов 4-го типа.
Блокатор PD-1 – моноклональное антитело, блокирующее рецептор программируемой клеточной смерти 1.
Блокатор PD-L1 – моноклональное антитело, блокирующее лиганд рецептора программируемой клеточной смерти 1.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации) в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Генерализованный почечно-клеточный рак – рак паренхимы почки с метастазами.
Диссеминированный почечно-клеточный рак – рак паренхимы почки с метастазами.
Криоаблация почки – минимально-инвазивный метод лечения рака почки, предусматривающий лечебное воздействие на опухоль путем локального формирования зоны очень низкой температуры (‒40 ºС и ниже).
Метастазэктомия – операция, предусматривающая хирургическое удаление метастаза.
Метастатический почечно-клеточный рак – рак паренхимы почки с метастазами.
Неоадъювантная химиотерапия – вид химиотерапии, проводимый непосредственно перед хирургическим удалением первичной опухоли для улучшения результатов операции/лучевой терапии и для предотвращения образования метастазов.
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Предреабилитация (prehabilitation) – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Радикальная нефрэктомия – метод хирургического лечения рака почки, заключающийся в ее удалении.
Резекция почки – метод хирургического лечения рака почки, заключающийся в проведении органосохраняющей операции, предусматривающей удаление опухоли с минимальным количеством прилежащей к ней «здоровой» паренхимы почки.
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Уровни достоверности доказательств – отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам достоверность доказательств определяется по 3 основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций – в отличие от уровней достоверности доказательств отражают степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесет в конкретной ситуации больше пользы, чем негативных последствий.
Циторедуктивная нефрэктомия – метод хирургического лечения рака почки, заключающийся в нефрэктомии и максимальном удалении всех опухолевых очагов в забрюшинном пространстве у пациентов с метастатическим раком паренхимы почки.
BAP1-TPDS (англ. BAP1 tumor predisposition syndrome) – BAP1-ассоциированный онкосиндром.
BHDS (англ. Birt–Hogg–Dube) – синдром Берта–Хогга–Дюбэ.
CTLA-4 – антиген цитотоксических Т-лимфоцитов 4-го типа.
HLRCC (англ. hereditary leiomyomatosis and renal cell cancer) – наследственный лейомиоматоз и почечно-клеточный рак.
HPRC (англ. hereditary papillary renal cancer) – наследственная папиллярная карцинома почки 1-го типа.
PD-1 – рецептор программируемой клеточной смерти 1.
PD-L1 – лиганд рецептора программируемой клеточной смерти 1.
VHL-синдром (англ. von Hippel–Lindau disease) – синдром Хиппеля–Линдау.
Рак паренхимы почки (почечно-клеточный рак, ПКР) – группа злокачественных новообразований почки, развивающихся из эпителия проксимальных канальцев или собирательных трубочек.
Этиология рака паренхимы почки неоднородна. Доказано увеличение риска развития ПКР по мере увеличения массы тела и возраста [1]. Предположительными факторами риска заболевания являются курение и артериальная гипертензия (АГ) [2, 3]. Описан ряд наследственных вариантов рака почки. Наиболее распространенным из них является ПКР, ассоциированный с синдромом Хиппеля–Линдау (VHL-синдром) и обусловленный аутосомно-доминантной герминальной мутацией расположенного на коротком плече хромосомы 3 (локус 3p25‒26) гена VHL, приводящей к развитию светлоклеточного ПКР (сПКР) и ряда других пролиферативных сосудистых поражений [4].
Рак паренхимы почки занимает 14-е место по заболеваемости среди злокачественных опухолей. В 2018 г. во всем мире зарегистрировано около 400 тыс. новых случаев ПКР. Наиболее высокая заболеваемость раком паренхимы почки зарегистрирована в Беларуси, Латвии и Литве, наименьшая – в Австралии, Бельгии и Сингапуре [5].
В России в структуре злокачественных новообразований ПКР составляет 4,0 % (4,8 % в мужской, 3,4 % в женской популяции). В 2017 г. в России было зарегистрировано 13 556 новых случаев рака паренхимы почки, стандартизованный показатель заболеваемости достиг 16,9 на 100 тыс. населения. Прирост заболеваемости за период с 2007 по 2017 г. составил 24,1 %.
За 2017 г. от рака паренхимы почки в России умерли 5180 пациентов, смертность составила 5,71 на 100 тыс. населения. Смертность от ПКР за период с 2007 по 2017 г. снизилась на 1,5 % (динамика показателя статистически незначима) [6].
По Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10) рак паренхимы почки имеет код: С64 – Злокачественное новообразование почки, кроме почечной лоханки [7].
Международная гистологическая классификация
Международная гистологическая классификация опухолей почки (классификация Всемирной организации здравоохранения (ВОЗ), 2016 г.) [8].
Почечно-клеточные опухоли
Светлоклеточный ПКР 8310/3
Мультилокулярная кистозная опухоль почки низкой степени злокачественности 8316/1
Папиллярный ПКР 8260/3
ПКР, ассоциированный с наследственным лейомиоматозом 8311/3
Хромофобный ПКР 8317/3
Рак из собирательных трубочек (Беллини) 8319/3
Медуллярный рак почки 8510/3
ПКР с MiT-транслокацией 8311/3
Сукцинатдегидрогеназо-дефицитный ПКР
Муцинозный тубулярный и веретеноклеточный рак 8480/3
Тубулокистозный ПКР 8316/3
ПКР, ассоциированный с кистозной болезнью почек 8316/3
Светлоклеточно-папиллярный ПКР 8323/1
Неклассифицируемый ПКР 8312/3
Папиллярная аденома 8260/0
Онкоцитома 8290/0
Метанефральные опухоли
Метанефральная аденома 8325/0
Метанефральная аденофиброма 9013/0
Метанефральная стромальная опухоль 8935/1
Нефробластические и кистозные опухоли, встречающиеся преимущественно у детей
Нефрогенные эмбриональные остатки
Нефробластома 8960/3
Кистозная частично дифференцированная нефробластома 8959/1
Кистозная нефрома детского возраста 8959/0
Мезенхимальные опухоли
Мезенхимальные опухоли, встречающиеся преимущественно у детей
Светлоклеточная саркома 8964/3
Рабдоидная опухоль 8963/3
Врожденная мезобластическая нефрома 8960/1
Оссифицирующая опухоль почки у детей 8967/0
Мезенхимальные опухоли, встречающиеся преимущественно у взрослых
Лейомиосаркома 8890/3
Ангиосаркома 9120/3
Рабдомиосаркома 8900/3
Остеосаркома 9180/3
Синовиальная саркома 9040/3
Саркома Юинга 9364/3
Ангиомиолипома 8860/0
Эпителиоидная ангиомиолипома 8860/1
Лейомиома 8890/0
Гемангиома 9120/0
Лимфангиома 9170/0
Гемангиобластома 9161/1
Юкстагломерулярноклеточная опухоль 8361/0
Опухоль из интерстициальных клеток мозгового вещества 8966/0
Шваннома 9560/0
Солитарная фиброзная опухоль 8815/1
Группа смешанных эпителиальных и стромальных опухолей
Кистозная нефрома 8959/0
Смешанная эпителиальная стромальная опухоль 8959/0
Нейроэндокринные опухоли
Высокодифференцированная нейроэндокринная опухоль 8240/3
Крупноклеточный нейроэндокринный рак 8013/3
Мелкоклеточный нейроэндокринный рак 8041/3
Параганглиома 8700/0
Прочие опухоли
Опухоли гемопоэтической ткани
Герминогенные опухоли
Метастатические опухоли
Ключевые изменения, внесенные в классификации ВОЗ
Для светлоклеточного и папиллярного ПКР ВОЗ/Международной ассоциацией урологических патологов (ISUP) рекомендована четырехступенчатая градирующая система (Grade 1–4) – система определения степени злокачественности опухоли, основанная на ядерных признаках и наличии саркоматоидной/рабдоидной дифференцировки [9].
Данная градирующая система не применима для хромофобного рака, так как Grade при этом гистологическом варианте не ассоциирован с прогнозом, но может быть использована для других вариантов ПКР, однако ее прогностическое значение неизвестно.
Четырехступенчатая система дифференцировки опухоли почки ВОЗ/ISUP [9]
Стадирование заболевания
Стадирование рака почки осуществляется в соответствии с классификацией TNM UICC 8-го пересмотра (2017 г.). Категории pT и pN соответствуют клиническим категориям T и N [10].
Т ‒ первичная опухоль
Критерий T:
o cТ1а ‒ опухоль ≤4 см в наибольшем измерении, не выходит за пределы почки;
o cТ1b ‒ опухоль >4 см, но ≤7 см в наибольшем измерении, не выходит за пределы почки.
o cТ2a ‒ опухоль >7 см, но ≤10 см, не выходит за пределы почки;
o cТ2b ‒ опухоль >10 см, не выходит за пределы почки.
o cT3a ‒ опухоль распространяется на почечную вену или сегментарные ветви почечной вены либо опухоль прорастает в периренальные ткани и/или клетчатку почечного синуса (в клетчатку, окружающую почечную лоханку), но не выходит за пределы фасции Героты;
o cT3b ‒ опухоль макроскопически распространяется в нижнюю полую вену (НПВ) ниже уровня диафрагмы;
o cT3c ‒ опухоль макроскопически распространяется в НПВ выше уровня диафрагмы или прорастает стенку НПВ.
N ‒ регионарные лимфатические узлы (ЛУ)
M ‒ отдаленные метастазы
Соответствие стадий опухолевого процесса в зависимости от категорий TNM представлено в табл. 1.
Таблица 1. Соответствие стадий опухолевого процесса категориям TNM
| Стадия | Категории | ||
|---|---|---|---|
| T | N | M | |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| T1, T2, T3 | N1 | M0 | |
| IV | T4 | N любое | M0 |
| T любое | N любое | M1 |
Нефрометрическая классификация опухолей почечной паренхимы
Оценка нефрометрических признаков на основании данных об анатомических особенностях опухоли, полученных с помощью методов предоперационной лучевой визуализации, позволяет унифицировать описание новообразований почечной паренхимы и их взаимосвязи с соседними структурами. Использование стандартизованных объективных и воспроизводимых шкал нивелирует вариабельность трактовки результатов визуализации разными специалистами. Нефрометрические показатели могут предсказать ожидаемую техническую сложность РП и коррелируют с длительностью ишемии, операционным временем, объемом кровопотери, частотой осложнений и вероятностью перехода от РП к РН. Нефрометрические шкалы могут помочь в принятии клинических решений в отношении объема операции и хирургического доступа.
Шкала RENAL
Нефрометрическая шкала RENAL основана на оценке 5 радиологических анатомических характеристик:
– (R)adius (максимальный диаметр опухоли),
– (E)xophytic/endophytic (экзофитный или эндофитный рост опухоли),
– (N)earness (близость расположения опухоли к собирательной системе почки или ее синусу),
– (A)nterior (a)/posterior (p)/not anterior or posterior (x) (расположение опухоли по передней, задней или не по передней или задней поверхности почки) и
– (L)ocation (расположение опухоли по отношению к полюсной линии) [11].
Суффикс -hilar (h) добавляется для описания опухолей, прилежащих к главной почечной артерии или вене (табл. 2). Каждой переменной, кроме A, присваивается от 1 до 3 баллов, что дает в общей сложности 3 балла для наименее сложной и 12 баллов для наиболее сложной в отношении РП опухоли. Общая оценка нефрометрического индекса производится по сумме баллов для каждой переменной (например, 1 + 2 + 2 + A + 3) и дополняется аббревиатурой, соответствующей переднезаднему расположению новообразования (например, 8A). Сложность РП классифицируется как низкая (индекс RENAL 4–6), умеренная (индекс RENAL 7–9) или высокая (индекс RENAL 10–12).
Шкала PADUA
Шкала PADUA (The Preoperative Aspects and Dimensions Used for an Anatomical) состоит из 6 оцениваемых по балльной системе параметров и индекса переднего или заднего расположения опухоли [12]. Переменные включают полюсную локализацию, экзофитный или эндофитный характер роста, отношение к краю почки, поражение почечного синуса, вовлечение собирательной системы и максимальный размер опухоли (табл. 2). Индекс рассчитывается как сумма этих параметров и имеет минимальное значение, равное 6, и максимальное, составляющее 14 баллов. РП соответствует низкой технической сложности при индексе PADUA 6–7, умеренной сложности при индексе 8–9 или высокой сложности при 10–14. Степень сложности операции коррелирует с риском осложнений.
Классификация опухолевого венозного тромбоза у больных ПКР
Уникальной особенностью ПКР является способность к венозной инвазии с формированием опухолевого тромбоза. Краниальная граница тромба является основным фактором, определяющим хирургическую тактику, что обосновывает актуальность клинического стадирования рака почки с опухолевым венозным тромбозом по данному признаку. Предложено несколько хирургических классификаций. Наиболее распространенной является система Novick, согласно которой опухолевый тромб почечной вены, пролабирующий в НПВ менее чем на 2 см, относят к I уровню, подпеченочный тромб – ко II уровню, внутрипеченочный тромбоз ниже диафрагмы – к III уровню, тромб, распространяющийся выше диафрагмы, – к IV [13].
Прогностическая классификация Memorial Sloan Kettering Cancer Center (MSKCC)
Для 670 пациентов с диссеминированным раком паренхимы почки, получавших цитокиновую иммунотерапию, были выделены факторы риска общей выживаемости (ОВ):
На основании наличия и количества имеющихся факторов риска выделены группы прогноза:
– хороший – 0 факторов риска;
– промежуточный – 1‒2 фактора;
– плохой – ≥3.
В настоящее время данная шкала не применяется для принятия клинических решений и приводится в рекомендациях для облегчения трактовки результатов исследований, использовавших данную классификационную систему [14].
Прогностическая классификация International Metastatic Renal Cancer Database Consortium (IMDC)
В 2009 г. было опубликовано исследование, включившее данные 645 пациентов с распространенным ПКР, получавших таргетную терапию. На основании анализа результатов лечения этой когорты пациентов были выделены факторы риска прогрессирования заболевания:
На основании наличия и количества имеющихся факторов риска выделены группы прогноза:
хороший – 0 факторов риска;
промежуточный – 1‒2 фактора;
плохой – ≥3.
Для определения оптимальной лечебной тактики при местно-распространенном неоперабельном и метастатическом ПКР (мПКР) необходима оценка группы прогноза IMDC [15].
Клиническая картина ПКР складывается из проявлений первичной опухоли, метастазов, а также паранеопластических симптомов. На ранних стадиях рак паренхимы почки, как правило, не вызывает жалоб. По мере роста первичная опухоль становится пальпируемой и может вызывать развитие боли и гематурии (классическая триада симптомов рака почки). Опухолевый венозный тромбоз левой почечной вены способен вызвать развитие варикоцеле слева. Распространение опухоли по просвету НПВ или наличие массивных метастазов в забрюшинных ЛУ может быть ассоциировано с появлением отеков нижних конечностей, сети расширенных подкожных вен на передней брюшной стенке («голова медузы»). Симптомы метастазов определяются их локализацией: поражение легких, плевры, внутригрудных ЛУ способно привести к развитию кашля, кровохарканья, одышки; симптомами метастазов в кости являются боль и патологические переломы; метастазы в печени часто сопровождаются гипертермией; метастазы в головном мозге проявляются общемозговыми и очаговыми неврологическими симптомами. Для рака паренхимы почки характерно развитие клинических паранеопластических симптомов, таких как АГ и лихорадка.
Критерии установления диагноза/состояния:
Клинический диагноз основан на результатах обследования:
У пациентов с выявленными солидными новообразованиями почки, накапливающими контрастный препарат при оптимальном лучевом исследовании (компьютерная томография (КТ) с контрастированием и/или магнитно-резонансная томография (МРТ) с контрастированием), хирургическое лечение возможно и при отсутствии морфологической верификации [16].
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Комментарий: на ранних стадиях рак паренхимы почки не вызывает жалоб у пациентов. По мере развития опухолевого процесса возможно появление жалоб на наличие опухоли в животе, самостоятельно обнаруженной пациентом, примеси крови в моче, боли в пояснице, АГ, повышения температуры тела, отеков нижних конечностей, сети вен под кожей живота, а у мужчин ‒ подкожных вен мошонки, а также кашля, кровохарканья, одышки, боли в костях, переломов костей, головной боли, неврологических нарушений. Пациенты с впервые выявленными распространенными формами рака паренхимы почки могут указывать на длительный (более 1 года) анамнез подобных жалоб.
Уровень убедительности рекомендаций ‒ C (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Комментарий: наиболее распространенные лабораторные отклонения от нормальных значений в общем клиническом анализе крови – снижение уровня гемоглобина (вследствие гематурии и/или паранеопластического токсико-анемического синдрома), повышение уровней эритроцитов, лейкоцитов, чаще всего за счет увеличения уровня нейтрофилов, тромбоцитов, увеличение скорости оседания эритроцитов (вследствие паранеопластического синдрома, ассоциированного с ПКР).
Наиболее распространенные лабораторные отклонения от нормальных значений в общетерапевтическом биохимическом анализе крови – повышение уровней креатинина, мочевины, калия (вследствие снижения почечной функции за счет уменьшения объема функционирующей паренхимы при ПКР или опухолевого блока контралатеральной почечной вены), повышение уровней аланинаминотрансферазы, аспарагинаминотрансферазы, билирубина преимущественно за счет непрямой фракции (вследствие наличия опухолевого блока главных печеночных вен или развития метастазов в печени), повышение уровня щелочной фосфатазы (вследствие развития метастазов в печени или костях), снижение уровня общего белка, альбумина (вследствие опухолевого катаболизма).
Уровень убедительности рекомендаций ‒ В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций ‒ A (уровень достоверности доказательств – 2).
Комментарий: наиболее распространенные лабораторные отклонения от нормальных значений – эритроцитурия (вследствие кровотечения в просвет собирательной системы почки), протеинурия (вследствие гематурии, реже – амилоидоза как проявления паранеопластического синдрома, ассоциированного с ПКР).
Уровень убедительности рекомендаций ‒ B (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций ‒ A (уровень достоверности доказательств – 2).
Комментарий: трансабдоминальное УЗИ является скрининговым методом. УЗИ позволяет выявить объемное образование почки, провести дифференциальную диагностику между кистозным образованием и солидной опухолью, оценить состояние почечной вены, НПВ, зон регионарного метастазирования, второй почки, надпочечников, печени, поджелудочной железы. УЗИ имеет низкую специфичность, поэтому результаты исследования должны быть подтверждены с использованием метода КТ.
Трансабдоминальное УЗИ можно использовать для навигации при выполнении чрескожной биопсии опухоли почки.
Интраоперационное УЗИ может быть использовано для выявления интрапаренхиматозных опухолей, дополнительных опухолей при планировании органосохраняющего лечения (РП, аблация опухолей почки), опухолевых тромбов в сегментарных ветвях почечной вены.
Уровень убедительности рекомендаций ‒ A (уровень достоверности доказательств ‒ 1).
Комментарий: КТ – стандарт диагностики ПКР. КТ позволяет оценить локализацию, размеры, количество опухолей почки, их синтопию с внутрипочечными структурами и окружающими органами, выявить и определить характеристики опухолевого венозного тромба, оценить состояние зон регионарного метастазирования, выявить метастатическое поражение органов брюшной полости. Рекомендуемая толщина реконструированного среза КТ должна составлять 1–3 мм. Новообразования почечной паренхимы описываются как солидные или кистозные.
Уровень убедительности рекомендаций ‒ A (уровень достоверности доказательств – 1).
Комментарий: в классификации Босняка кистозные образования почки делят на 5 категорий в зависимости от данных КТ и МРТ, что позволяет оценить риск злокачественного перерождения. В этой классификации указывается также способ лечения в зависимости от категории кисты (табл. 2).
Таблица 2. Классификация Босняка кистозных образований почки [36]
| Категория по Босняку | Особенности | Результат исследования |
|---|---|---|
| I | Тонкая (толщина менее 2 мм) стенка, в структуре отсутствуют септы или солидный компонент, отсутствуют кальцинаты.Плотность/сигнальные характеристики содержимого соответствуют серозной жидкости (воде), отсутствует накопление контрастного вещества | Простая доброкачественная киста |
| II | Киста четко очерченная, тонкая (толщина менее 2 мм) стенка,одиночные тонкие (толщиной менее 1 мм) септы,волосяной (неизмеримой) толщины или точечные кальцинаты в стенке или септах.Видимое, но неизмеримое накопление контрастного вещества стенкой или септами не накапливающие контрастное вещество кисты с содержимым несерозного характера размером менее 3 см, плотность/сигнальные характеристики соответствуют белковому/геморрагическому содержимому | Доброкачественная, минимально осложненная киста |
| IIF | Киста четко очерченная, множественные тонкие (толщиной менее 1 мм) септы или минимально утолщенные стенка или септы, нодулярные, линейные измеримой толщины кальцинаты в стенке или септах.Интраренально расположенные не накапливающие контрастное вещество кисты с содержимым несерозного характера размером более 3 см, плотность/сигнальные характеристики соответствуют белковому/геморрагическому содержимому. Видимое, но неизмеримое накопление контрастного вещества стенкой или септами | Минимально осложненная киста |
| III | Утолщенные ровные или неровные стенка и септы, накапливающие контрастное вещество (измеримое накопление контрастного вещества) | Киста неопределенного характера |
| IV | Утолщенные ровные или неровные стенка и септы, солидный компонент, прилежащий к стенке и септам, накапливающие контрастное вещество (измеримое накопление контрастного вещества) | Киста определенно злокачественного характера |
Протокол мультидетекторной КТ включает нативную фазу, кортикомедуллярную фазу (через 40 с после начала введения контрастного препарата), нефрографическую фазу (через 90 с после начала введения контрастного препарата) и урографическую фазу (через 7 мин после введения контрастного препарата). Накопление контрастного вещества новообразованием почки (по данным КТ градиент повышения плотности на фоне контрастного усиления >15–20 единиц Хаунсфилда (HU)) считается наиболее значимым признаком, свидетельствующим о злокачественности новообразования почки; наиболее информативной в оценке степени накопления контрастного вещества является нефрографическая фаза. Кортикомедуллярная фаза используется для оценки артериальной системы, прежде всего количества почечных артерий и артерий, питающих новообразование. Урографическая фаза применяется для оценки синтопии опухоли и чашечно-лоханочной системы почки. Трехмерная КТ-реконструкция отображает анатомию сосудов почки, взаимоотношение почечной паренхимы и новообразования в привычном для врачей-хирургов формате, а также помогает планировать хирургический доступ, объем и ход оперативного вмешательства.
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Комментарий: при наличии головки тромба в просвете правых камер сердца оценивают размер внутрисердечного компонента опухоли, его плотность, фиксацию к эндокарду, пролабирование из правого предсердия в правый желудочек, наличие неопухолевого, сосудистого компонента тромба.
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций ‒ B (уровень достоверности доказательств – 1).
Комментарий: у пациентов с ПКР стадии cT1a, cN0, не имеющих общих симптомов заболевания, без анемии и тромбоцитоза рекомендуется ограничиться рентгенографией органов грудной клетки.
Допускается заменить КТ органов грудной клетки на рентгенографию органов грудной клетки, если оптимальный вариант лучевой диагностики не может быть проведен в течение 4 нед после установления диагноза.
КТ органов грудной клетки ‒ стандартный метод оценки состояния легких, плевры, а при использовании в/в контрастирования ‒ внутригрудных ЛУ и сосудов. КТ позволяет выявить опухолевое поражение легочной паренхимы, плевры, определить наличие плеврального выпота и тромбоэмболов в просвете ветвей легочных артерий после состоявшейся тромбоэмболии фрагментами опухолевого венозного тромба. Диагностическая точность рентгенографии органов грудной клетки ниже, чем КТ органов грудной клетки.
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций ‒ В (уровень достоверности доказательств – 2).
Комментарий: с учетом того, что в большинстве случаев костные метастазы ПКР являются литическими, чувствительность метода недостаточно высокая [55]. Оптимальным методом диагностики костных метастазов при ПКР является КТ.
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 1).
Комментарий: если оптимальный вариант лучевой диагностики не может быть проведен в течение 4 нед после выявления синдрома повышенного накопления РФП при сцинтиграфии костей всего тела (остеосцинтиграфии), КТ и/или МРТ костей допускается заменить на прицельную рентгенографию костей.
Диагностическая точность КТ и/или МРТ в подтверждении метастатического поражения костей с повышенным накоплением РФП выше, чем у рентгенографии костей скелета.
При сомнительных результатах стандартных методов исследований в определении костных метастазов, может использоваться ПЭТ/КТ с флудезоксиглюкозой [18F] [61].
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Комментарий: в случае невозможности выполнить МРТ головного мозга с в/в контрастированием (срок ожидания очереди на исследование ˃1 мес) допускается выполнить КТ головного мозга с в/в контрастированием. Не рекомендуется выполнение КТ головного мозга без в/в контрастирования.
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций ‒ B (уровень достоверности доказательств – 1).
Комментарий: роль ПЭТ/КТ в диагностике ПКР и наблюдении за пациентами после проведенного лечения окончательно не ясна, поэтому ПЭТ/КТ в настоящее время не является стандартным методом исследования у пациентов с ПКР. По сравнению с КТ с в/в контрастированием ПЭТ/КТ с РФП имеет меньшую чувствительность в выявлении первичной опухоли ПКР, но бóльшую чувствительность в выявлении отдаленных метастазов.
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций ‒ A (уровень достоверности доказательств – 1).
Комментарий: объектом морфологического (патолого-анатомического исследования биопсийного (операционного) материала почек (или, при необходимости, материала метастазов) и/или цитологического исследования микропрепарата тканей (или, при необходимости, тканей метастазов)) является биоптат опухоли почки или метастаза ПКР либо операционный материал. Возможно использование цитологического и/или гистологического методов верификации диагноза.
Уровень убедительности рекомендаций ‒ A (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций ‒ C (уровень достоверности доказательств – 3).
Комментарий:
Наследственные онкологические синдромы, при которых развиваются опухоли почки:
1. Синдром Хиппеля–Линдау (VHL-синдром; OMIM 193300) – аутосомно-доминантный наследственный онкологический синдром с частотой 1:36 тыс. новорожденных и пенетрантностью 90 % к возрасту 65 лет. Опухоли могут развиваться в органах-мишенях в различном возрасте: наиболее часто встречаются сПКР (нередко мультифокальный и/или билатеральный), кисты почек и поджелудочной железы, гемангиобластомы центральной нервной системы и сетчатки (множественные ангиомы сетчатки), феохромоцитома надпочечника, параганглиома, гораздо реже – нейроэндокринные опухоли, опухоли эндолимфатического протока внутреннего уха, кистозные аденомы придатка яичка. Средний возраст манифестации заболевания – 25–30 лет. Самым частым проявлением VHL-синдрома является сПКР, он выявляется у 75 % пациентов. Выделяют VHL-синдром 1-го типа (без феохромоцитомы и с высоким риском развития ПКР) и 2-го типа (с феохромоцитомой). В свою очередь, VHL-синдром 2-го типа подразделяют на типы 2А (низкий риск ПКР), 2В (высокий риск ПКР) и 2С (только феохромоцитома). VHL-синдром обусловлен мутациями в гене VHL, который локализован в области 3р25. Молекулярно-генетическая диагностика VHL-синдрома заключается в идентификации инактивирующей герминальной мутации в гене VHL – причины заболевания. Основной метод анализа – полимеразная цепная реакция (ПЦР) с последующим секвенированием по Сэнгеру экзонов 1–3 гена VHL, что позволяет выявить точковую мутацию в 85 % семей с VHL-синдромом. При отрицательном результате секвенирования проводят поиск делеций VHL методом мультиплексной амплификации лигированных зондов (multiplex ligation-dependent probe amplification, MLPA).
2. Синдром Берта–Хогга–Дюбэ (Birt–Hogg–Dube, BHDS; OMIM 135150) – аутосомно-доминантный онкологический синдром, основным проявлением которого более чем в 90 % случаев является развитие множественных фиброфолликулом. Они локализуются преимущественно на лице, шее и верхней части туловища. Примерно у 80 % больных развиваются легочные кисты, что приводит к спонтанному пневмотораксу. У 50 % пациентов с BHDS развиваются опухоли почки. В качестве минимальных диагностических критериев, позволяющих поставить предварительный диагноз BHDS, рассматривают: 1) присутствие не менее 2 характерных новообразований кожи, из которых как минимум одно гистологически подтверждено как фиброфолликулома после достижения пубертатного периода; 2) билатеральные (мультифокальные) кисты в базальных отделах легких, диагностированные до 40 лет, и наличие семейной истории заболевания; 3) билатеральные (мультифокальные) хромофобные или гибридные онкоцито-хромофобные опухоли почки при наследственном ПКР; 4) комбинация кожных, легочных и/или почечных симптомов BHDS у пациента и в его родословной. ПКР при этом синдроме часто мультифокальный, билатеральный, в большинстве случаев представлен хромофобной карциномой, реже описаны гибридные онкоцито-хромофобные опухоли и другие типы ПКР. Несмотря на то что фиброфолликуломы кожи считают наиболее частым проявлением BHDS, развитие опухолей (в том числе ПКР) у пациентов с этим синдромом, как правило, начинается лишь в среднем возрасте. У молодых пациентов ведущей BHDS-ассоциированной патологией является развитие легочных кист, которые начинают формироваться уже в подростковом возрасте, и уже к 40 годам в 30 % случаев BHDS в анамнезе имеется спонтанный пневмоторакс. BHDS развивается вследствие инактивирующих герминальных мутаций в гене-супрессоре FLCN, локализованном в области 17р11.2 и кодирующем фолликулин. Молекулярно-генетическая диагностика синдрома BHDS заключается в идентификации инактивирующей герминальной мутации FLCN – причины заболевания. Основной метод анализа – ПЦР с последующим секвенированием по Сэнгеру экзонов 4–14 гена FLCN, которые кодируют полипептидную цепь. При отрицательном результате секвенирования анализ может быть дополнен поиском делеций FLCN методом MLPA.
3. Наследственная папиллярная карцинома почки 1-го типа (hereditary papillary renal cancer, HPRC; OMIM 605074) – аутосомно-доминантное заболевание, характеризующееся развитием множественных почечно-клеточных папиллярных карцином 1-го типа. Причина этой формы наследственного ПКР – активирующие мутации в онкогене МЕТ, локализованном в районе 7q31 и кодирующем тирозинкиназный рецептор. Мутации МЕТ при HPRC затрагивают структуру цитоплазматического домена рецептора и приводят к его конститутивной активации. Молекулярно-генетическая диагностика HPRC заключается в идентификации активирующей герминальной мутации в экзонах 15–21 гена МЕТ с помощью ПЦР и секвенирования по Сэнгеру.
4. Наследственный лейомиоматоз и почечно-клеточный рак (hereditary leiomyomatosis and renal cell cancer, HLRCC; OMIM 150800) – аутосомно-доминантный онкологический синдром с частотой 1:200 тыс. новорожденных, основным проявлением которого является развитие множественных лейомиом кожи и матки. Примерно у 15 % больных развивается ПКР, представленный папиллярными карциномами 2-го типа. Несмотря на то что ПКР не является основным проявлением HLRCC, манифестирует он в молодом возрасте – в среднем до 40 лет. В качестве минимальных диагностических критериев, позволяющих поставить предварительный диагноз HLRCC, рассматривают множественные лейомиомы кожи и матки (у женщин) и семейную историю заболевания, а также сочетание лейомиом и ПКР. HLRCC развивается вследствие инактивирующих герминальных мутаций в гене-супрессоре FH, локализованном в области 1q43 и кодирующем фумаратгидратазу – фермент цикла Кребса. Молекулярно-генетическая диагностика HLRCC заключается в идентификации герминальной инактивирующей мутации FH – причины заболевания. Основной метод анализа – ПЦР и секвенирование по Сэнгеру экзонов 1–10 гена FH. При отрицательном результате анализ этого гена может быть дополнен поиском делеций с помощью MLPA.
5. Наследственная феохромоцитома/параганглиома – редкий наследственный онкологический синдром, при котором могут развиваться опухоли почек различных типов. Заболевание обусловлено инактивирующими герминальными мутациями в генах SDHA, SDHB, SDHC, SDHD или SDHAF2, кодирующих сукцинатдегидрогеназный комплекс. Большинство описанных случаев связаны с мутациями SDHB и SDHD; иммуногистохимическое окрашивание на SDHB применяют в рутинной патоморфологической диагностике. Молекулярно-генетическая диагностика заключается в идентификации мутации – причины заболевания – в указанных выше генах семейства SDH с помощью ВПС.
6. BAP1-ассоциированный онкосиндром (BAP1 tumor predisposition syndrome, BAP1-TPDS; OMIM 614327) – редкий аутосомно-доминантный онкологический синдром, при котором развиваются мезотелиомы, меланомы, в части случаев – сПКР. BAP1-TPDS обусловлен герминальной мутацией в гене-супрессоре ВАР1. Молекулярно-генетическая диагностика заключается в идентификации мутации ВАР1 методом ВПС [102].
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлены на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкциях мер предосторожности при их применении; также возможна коррекция доз с учетом состояния пациента.
Наиболее эффективным методом лечения ПКР остается хирургический. Клинически локализованные формы ПКР (стадии сТ1-T2N0M0) являются показанием к РП или радикальной нефрэктомии (РН). Новообразования, размер и локализация которых позволяют выполнить органосохраняющие операции, рассматриваются как показания к РП. Для остальных случаев методом выбора лечения клинически локализованного ПКР является РН.
Радикальная нефрэктомия – основной подход к лечению операбельных местно-распространенных форм заболевания (стадии cT3-T4N0-1M0). При распространении опухоли по просвету почечной вены и НПВ (категории сТ3а-Т4) объем операции расширяется до РН с тромбэктомией. Опухолевая инвазия соседних структур и органов (категория cT4) является показанием для их резекции.
Отобранным пациентам с солитарными и единичными метастазами рака почки рекомендуется полное хирургическое удаление первичной опухоли и метастатических очагов. Пациентам с ПКР с множественными метастазами, относящимся к группе благоприятного прогноза IMDC, показана циторедуктивная нефрэктомия (цНЭ) до начала системной противоопухолевой терапии.
Около 1/3 заболевших на момент выявления опухоли почки имеют отдаленные метастазы. У 30 % пациентов, подвергнутых радикальному хирургическому лечению, в процессе дальнейшего наблюдения развивается диссеминация опухолевого процесса. В связи с этим около 50 % пациентов, страдающих ПКР, нуждаются или будут нуждаться в системной противоопухолевой терапии.
Для лечения неоперабельного местно-распространенного и диссеминированного ПКР используются режимы системной лекарственной терапии, основанные на таргетных ингибиторах фактора роста эндотелия сосудов (VEGF), мультикиназных ингибиторах рецепторов ростовых факторов, мишени рапамицина млекопитающих (mTOR), агентах, блокирующих белок программируемой клеточной смерти лимфоцитов (PD-1) или его лиганд 1-го типа (PD-L1), а также антителах к цитотоксическому Т-лимфоциту 4-го типа (CTLA-4).
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 1).
Комментарий (доказательная база): РП сравнивали с РН в единственном рандомизированном исследовании III фазы, проведенном European Organization for Research and Treatment of Cancer Genito-Urinary Group (EORTC-GU), разработанном в дизайне non-inferiority («не хуже») и преждевременно закрытом из-за плохого набора пациентов (541 из 1300 запланированных рекрутов). В исследование включали пациентов с удобными для органосохраняющего вмешательства опухолями почечной паренхимы размерами <4 см. Анализ результатов был проведен согласно группе рандомизации и продемонстрировал тенденцию к уменьшению ОВ в группе РП по сравнению с РН при медиане наблюдения 9,3 года (отношение шансов (ОШ) 1,5; 95 % доверительный интервал (ДИ) 1,03‒2,16; р = 0,03). Недостаточное количество рецидивов и смертей у незапланированно малого числа пациентов не позволило адекватно провести сравнение безрецидивной (БРВ) и специфической (СВ) выживаемости между группами [103].
Проведено несколько метаанализов исследований, сравнивающих РП и РН при клинически локализованных опухолях почечной паренхимы. Рабочая группа Cochrane Database of Systematic Reviews (2017) провела метаанализ данных 541 пациента с клинически локализованным раком паренхимы почки, подвергнутого органосохраняющему или органоуносящему лечению в рамках протокола EORTC 30904. При медиане наблюдения 9,3 года зарегистрировано увеличение риска смерти от любой причины при выполнении РП (ОШ 1,50; 95 % ДИ 1,03‒2,18). Уровень доказательности исследования низкий [104].
Канадский метаанализ (2016) индивидуальных данных пациентов с раком паренхимы почки T1N0M0, вошедших в Canadian Kidney Cancer Information System, которым выполняли РП (n = 1615) или РН (n = 2358), не выявил достоверных различий времени до прогрессирования в группах (ОШ 1,17; 95 % ДИ 0,8‒1,72; р = 0,42) [105]. В метаанализе (2017) 21 сравнительного исследования РН (n = 8620) и РП (n = 2584) при ПКР категорий cТ1b-Т2 отмечено снижение риска местного рецидива в группе РП (отношение рисков (ОР) 0,6; p <0,001), смерти от прогрессирования ПКР (ОР 0,58; p = 0,001) и смерти от любой причины (ОР 0,67; p = 0,005).
В субанализе 4 исследований, сравнивавших РП (n = 212) и РН (n = 1792) при категории сТ2, органосохраняющий подход достоверно снижал риск рецидива (ОР 0,61; p = 0,004) и риск смерти от рака почки (ОР 0,65; p = 0,03) [106]. Последний к настоящему времени метаанализ (2019) 16 исследований, включивший данные 33 117 пациентов с раком паренхимы почки сТ1b, показал, что РП обеспечивает сопоставимую с РН 10-летнюю БРВ и ОВ, уступая в отношении СВ (ОР 1,04; р <0,05) [107].
Доказана онкологическая безопасность применения эндоскопического доступа для РП при ПКР. Эндоскопическая РП ассоциирована с уменьшением интенсивности и длительности послеоперационного болевого синдрома, потребности в обезболивающих препаратах и длительности пребывания в стационаре [108].
Показания к РП. Выделяют абсолютные, относительные и элективные показания к РП. Абсолютными показаниями к органосохраняющему лечению считаются наличие опухоли единственной почки, в том числе единственной функционирующей, или двустороннее опухолевое поражение почек. К относительным показаниям относят опухоль почечной паренхимы при функционирующей контралатеральной почке у пациентов с сопутствующими заболеваниями, способными привести к ухудшению почечной функции (хронический пиелонефрит, хронический гломерулонефрит, мочекаменная болезнь, сахарный диабет, АГ, атеросклероз сосудов, нефросклероз и др.). Элективные показания к органосохраняющему хирургическому лечению имеют пациенты с клинически локализованным ПКР (стадии сТ1-Т2N0M0) с интактной второй почкой.
Основные цели РП: радикальность, морфологически подтвержденная отсутствием опухолевых клеток по краю разреза; минимальное снижение почечной функции за счет сохранения максимально возможного объема паренхимы и наименьшего времени ишемии и отсутствие специфичных осложнений, таких как кровотечение из зоны резекции и мочевой затек.
При выполнении РП должны соблюдаться следующие принципы: удобный доступ (допустимо использование открытого лапаротомного или внебрюшинного, эндоскопического – лапароскопического или ретроперитонеоскопического доступов); контроль почечных сосудов; удаление опухоли с прилежащей паранефральной клетчаткой в пределах визуально неизмененных тканей; герметичное ушивание собирательной системы и надежный гемостаз.
Уровень убедительности рекомендаций ‒ С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 1).
Комментарий (доказательная база): онкологическая эффективность РН, в течение долгих лет являвшейся стандартом лечения любых опухолей почечной паренхимы, доказана в исторических сериях наблюдений [112], подтверждена результатами рандомизированного исследования EORTC 30904 [104] и последующих метаанализов [105–107].
Классический объем РН, включающий экстрафасциальное удаление опухолевопораженной почки с паранефральной клетчаткой, ипсилатеральным надпочечником и регионарными ЛУ, остается актуальным только для лечения местно-распространенного ПКР. При клинически локализованном раке паренхимы почки доказано, что удаление ипсилатерального надпочечника не влияет на ОВ и СВ [113, 114]. В связи со значительной вариабельностью путей лимфооттока от почек стандартных границ лимфодиссекции при ПКР не существует. По данным рандомизированного исследования EORTC 30881, сравнивающего результаты РН с рутинной лимфодиссекцией и без нее у пациентов с ПКР с визуально неизмененными забрюшинными ЛУ, частота выявления регионарных микрометастазов составила 3,3 %. Выполнение рутинной лимфодиссекции не влияло на выживаемость, но не приводило к увеличению частоты осложнений [115].
Доказана онкологическая безопасность применения эндоскопического доступа для РН. Лапароскопическая РН ассоциирована с уменьшением интенсивности и длительности послеоперационного болевого синдрома, потребности в обезболивающих препаратах и длительности пребывания в стационаре [116, 117].
Показания к РН: клинически локализованный ПКР (стадии сТ1-Т2N0M0) при опухолях, не подходящих для РП; местно-распространенный рак паренхимы почки (сТ3a-T4N0-1M0).
Основная цель РН ‒ полное удаление всех определяемых опухолевых узлов.
Принципы РН зависят от клинической стадии ПКР.
При выполнении РН у пациентов с клинически локализованным ПКР (стадии сТ1-Т2N0M0) следует использовать удобный для врача-хирурга доступ (предпочтение должно отдаваться лапароскопическому доступу). Объем операции должен включать удаление почки с паранефральной клетчаткой. При отсутствии радиологически определяемых опухолевых узлов в ипсилатеральном надпочечнике, подтвержденном при интраоперационной ревизии, адреналэктомия со стороны поражения почки не показана. Регионарная лимфаденэктомия может быть выполнена со стадирующей целью по решению оперирующего врача-хирурга.
При выполнении РН при местно-распространенном раке паренхимы почки (стадии сТ3а-Т4N0-1M0) должен быть использован чрезбрюшинный доступ (предпочтение должно отдаваться лапаротомии). Объем операции должен включать экстрафасциальное удаление почки с паранефральной клетчаткой и регионарными ЛУ (паракавальными и аортокавальными – при опухоли правой, парааортальными и аортокавальными – при опухоли левой почки). Ипсилатеральная адреналэктомия оправдана при наличии массивных опухолей, поражении верхнего полюса почки, подозрении на метастатическое или местно-инвазивное поражение надпочечника. Врастание опухоли почки в соседние органы служит показанием к их резекции.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий (доказательная база): онкологическая эффективность РН, тромбэктомии доказана в сериях наблюдений [23, 118].
В многоцентровом исследовании, включающем 63 пациентов, подвергнутых тромбэктомии при ПКР с тромбозом IV уровня по Novick в условиях искусственного кровообращения, было показано, что фармакохолодовая кардиоплегия позволяет снизить частоту осложнений с 37,5 до 8,3 % (р = 0,006) [119].
Показания к РН, тромбэктомии: местно-распространенный рак почки с опухолевым венозным тромбозом почечной вены, НПВ, правого предсердия, правого желудочка сердца без или с инвазией стенок вен и/или эндокарда (сТ3a-T4N0-1M0).
Основные задачи, стоящие перед операционной бригадой во время РН, тромбэктомии: 1) профилактика тромбоэмболии легочной артерии на этапе мобилизации НПВ; 2) радикальное удаление всех опухолевых масс; 3) профилактика массивной одномоментной кровопотери; 4) восстановление адекватного венозного оттока от контралатеральной почки и печени в НПВ, а также из системы НПВ в правое предсердие.
Для решения поставленных задач следует соблюдать ряд основных принципов: 1) широкий доступ, обеспечивающий экспозицию пораженной почки и НПВ (с возможностью быстрой мобилизации интраперикардиальной НПВ и правого предсердия при тромбозе III−IV уровней); 2) доступ в забрюшинное пространство справа для контроля НПВ; 3) полная мобилизация почки с паранефрием до тромбэктомии; 3) циркулярная мобилизация тромбированной НПВ с перевязкой всех впадающих в нее коллатералей; 4) выполнение кавотомии, тромбэктомии в условиях «сухого» операционного поля за счет пережатия НПВ выше и ниже тромба, а также контралатеральной почечной вены (при тромбозе III−IV уровней также необходимо пережатие гепатодуоденальной связки); 5) тщательная визуальная ревизия внутренней поверхности НПВ после тромбэктомии и полное удаление резидуальных опухолевых очагов; 6) реконструкция НПВ (с сохранением нормальной анатомии венозного русла или без него); 7) для безопасного контроля верхушки тромба, уходящего в правые отделы сердца, целесообразно использование искусственного кровообращения (предпочтительно с холодовой кардиоплегией).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Комментарий (доказательная база): в течение 2 десятилетий цНЭ в комбинации с лекарственной терапией оставалась стандартом лечения мПКР, обеспечивая преимущество в показателях ОВ по сравнению с системной цитокиновой и таргетной терапией, по данным 2 рандомизированных [123, 124] и нескольких крупных ретроспективных исследований [125, 126]. Ретроспективный анализ (n = 1658) показал, что цНЭ достоверно увеличивает ОВ только у пациентов с 4 факторами риска IMDC или менее [126]. Результаты рандомизированного исследования III фазы CARMENA, включившего 43 % пациентов группы плохого прогноза по классификации MSKCC, продемонстрировали, что цНЭ с последующим назначением сунитиниба** не уступает таргетной терапии сунитинибом** в отношении ОВ. Медианы ОВ в группах составили 13,9 и 18,4 мес соответственно с ОР смерти 0,89 и 95 % ДИ 0,71−1,10, что не превышает фиксированный лимит non-inferiority 1,2, заложенный дизайном клинического протокола [127]. Эксплоративный анализ вторичных целей рандомизированного исследования EORTC SURTIМE показал, что отсроченная цНЭ после индукционной терапии сунитинибом** у больных группы промежуточного прогноза улучшает показатели ОВ по сравнению с немедленной цНЭ (медиана ОВ 32,4 и 15,0 мес соответственно, ОР 0,57 (95 % ДИ 0,34−0,95), p = 0,032) [128]. Роль цНЭ у пациентов с мПКР, получающих иммунотерапию ингибиторами PD-(L)1 и CTLA-4, не изучалась.
В ретроспективных сериях наблюдений показано, что удаление максимально возможного объема опухоли во время цНЭ коррелирует с ОВ [129, 130].
Показания к цНЭ: наличие технически удаляемой первичной опухоли у пациентов с ПКР, способных перенести хирургическое вмешательство, относящихся к:
Цель: улучшить результаты системного лечения мПКР.
Принципы: во время цНЭ необходимо стремиться к полному удалению всех опухолевых очагов в забрюшинном пространстве, включая опухолево пораженную почку и регионарные метастазы.
Уровень убедительности рекомендаций − В (уровень достоверности доказательств − 2).
Комментарий (доказательная база): В зависимости от локализации метастазов и состояния пациентов могут быть выполнены хирургические вмешательства: адреналэктомия открытая или эндоскопическая (в том числе адреналэктомия, или адреналэктомия с резекцией соседних органов), забрюшинная лимфаденэктомия, резекция печени, резекция легкого (в том числе видеоассистированная атипичная резекция легкого), медиастинальная лимфаденэктомия (в том числе медиастинальная лимфаденэктомия с использованием видеоэндоскопических технологий), удаление новообразования мягких тканей, удаление костного метастаза, микрохирургическое удаление новообразований головного мозга и др.
По данным ретроспективных серий наблюдений и систематизированного обзора публикаций, удаление солитарных и единичных метастазов существенно увеличивает выживаемость по сравнению с историческим контролем и улучшает качество жизни пациентов с ПКР [131–134].
Показания: ПКР с солитарными или единичными (≤2) метастазами любой локализации, которые могут быть радикально удалены одномоментно или последовательно с первичной опухолью. У отобранных пациентов с диссеминированным ПКР с симптомными метастазами в кости или головной мозг допустимо удаление метастазов данных локализаций с паллиативной целью.
Основная цель: удаление всех определяемых опухолевых очагов, вторичная – улучшение качества жизни.
Удаление костных метастазов выполняется для коррекции и предотвращения патологических переломов, сохранения двигательной активности, устранения болей, ликвидации компрессии спинного мозга при метастазах в позвоночник. Удаление метастазов из головного мозга сопровождается практически полным симптоматическим выздоровлением и значимым улучшением качества жизни.
Уровень убедительности рекомендаций − В (уровень достоверности доказательств − 3).
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Комментарий (доказательная база): в популяционных исследованиях продемонстрировано достоверное увеличение опухолевоспецифической выживаемости у пациентов с ПКР, подвергнутых хирургическому лечению, по сравнению с нехирургическим [141, 142]. Однако у пациентов старше 75 лет удаление опухоли не было ассоциировано с преимуществом СВ [143–145]. В 1 популяционном исследовании группа пациентов, находившихся под динамическим наблюдением, была старше, имела бóльшую частоту сопутствующих заболеваний, ассоциированных с потенциальным уменьшением функциональной переносимости хирургического вмешательства, по сравнению с оперированными пациентами. Летальность, не обусловленная ПКР, была достоверно выше у пациентов, не получавших хирургического лечения, чем у оперированных [142].
Динамическое наблюдение за пациентами с малыми опухолями почек продемонстрировало низкий темп увеличения новообразований и невысокую частоту метастазирования (1−2 %). При среднесрочном наблюдении не отмечено достоверных различий в показателях ОВ между оперированными и находящимися под динамическим наблюдением пациентами. Не зарегистрировано значимого отрицательного влияния динамического наблюдения на частоту и степень тяжести депрессий и тревожности пациентов [146].
Показания к динамическому наблюдению: ПКР cТ1aN0M0 у пациентов старше 75 лет и/или имеющих тяжелые сопутствующие или конкурирующие заболевания, обусловливающие ожидаемую продолжительность жизни <5 лет и/или ассоциированные с высоким операционным риском.
Цель: избежать выполнения хирургического вмешательства и ассоциированных с ним рисков осложнений и смерти у пациентов, для которых ПКР cТ1aN0M0 является клинически незначимым.
Принципы: динамическое наблюдение подразумевает регулярную (1 раз в 12 мес) оценку размеров опухоли почки с помощью одного и того же метода визуализации. Отсутствие изменений позволяет продолжать динамическое наблюдение; рост опухоли является показанием к хирургическому лечению.
Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 5).
Комментарий (доказательная база): исследований, касающихся оценки результатов применения выжидательной тактики при ПКР, нет. Можно предположить, что они могут перекликаться с данными, касающимися динамического наблюдения у пациентов старше 75 лет.
Показания: операбельный клинически локализованный или местно-распространенный ПКР стадий сТ1-Т4N0-1M0 у пациентов, имеющих тяжелые сопутствующие или конкурирующие заболевания, ассоциированные с крайне высоким операционным риском.
Цель: избежать выполнения хирургического вмешательства и ассоциированных с ним рисков осложнений и смерти у пациентов, не имеющих жизнеугрожающих осложнений ПКР.
Принципы: после первичной оценки степени распространенности ПКР и определения операционного риска проводится только контроль симптомов опухолевого процесса. Радиологическая визуализация требуется только при развитии симптомов опухоли почки, не поддающихся консервативному лечению. Хирургическое лечение выполняется только по жизненным показаниям.
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Комментарий (доказательная база): метаанализ данных 3974 пациентов, подвергнутых аблации (РЧА или криоаблации) или РП, показал бóльшую летальность от любых причин (ОР 2,11) и от рака почки (ОР 3,84) при использовании аблативного лечения. Частота местных рецидивов и метастазирования в группах не различалась. Частота осложнений была ниже в группе аблации по сравнению с РП (13 и 17,6 % соответственно, p <0,05). РП оказалась ассоциированной с достоверно бóльшим снижением скорости клубочковой фильтрации по сравнению с аблацией [148].
В другом метаанализе продемонстрирована сопоставимая частота осложнений и снижения скорости клубочковой фильтрации у пациентов, подвергнутых РП и РЧА. Частота местных рецидивов была выше после РЧА, чем после хирургического лечения (ОР 1,81), а частота развития метастазов в группах оказалась одинаковой [149].
В 3 ретроспективных исследованиях сравнивали РЧА и хирургическое лечение при ПКР стадии сТ1а и не выявили различий выживаемости между группами [150–152]. В ретроспективном исследовании, сравнивавшем РЧА и РП при ПКР T1b, результаты аблативного лечения при медиане наблюдения 78 мес уступали таковым при хирургическом вмешательстве [153].
В 4 исследованиях сравнивали результаты перкутанной и лапароскопической РЧА при ПКР. Частота осложнений процедуры не зависела от доступа. В 3 исследованиях не выявлены различия в частоте рецидивов и СВ между группами [154–156], в 1 серии наблюдений отмечено увеличение частоты неполной аблации при использовании перкутанного доступа [157]. Однако в 3 сравнительных исследованиях не было обнаружено различий по рецидивам или опухолевоспецифической выживаемости.
В 2 исследованиях сравнивали РЧА и криоаблацию и не выявили различий частоты осложнений, а также ОВ, СВ и БРВ между группами; в одной серии наблюдений частота длительного местного контроля над опухолью оказалась выше после РЧА, во второй, напротив, − после криоаблации [158, 159].
Доказана техническая возможность выполнения микроволновой термоаблации, лазерной аблации и аблации фокусированной ультразвуковой волной высокой интенсивности. Эти методики являются экспериментальными и в широкой клинической практике применяться не должны.
Показания: ПКР cТ1aN0M0 у пациентов старше 75 лет и/или имеющих тяжелые сопутствующие или конкурирующие заболевания, обусловливающие ожидаемую продолжительность жизни <5 лет и/или ассоциированные с высоким операционным риском.
Цель: достичь длительного локального контроля над опухолью, избежав выполнения хирургического вмешательства и ассоциированных с ним рисков осложнений и смерти.
Принципы: возможно применение РЧА и криоаблации ПКР. Другие методы аблации опухоли (микроволновая, лазерная или аблация высокоинтенсивным сфокусированным ультразвуком) могут применяться только в рамках клинических исследований. Аблативное лечение может осуществляться перкутанным или лапароскопическим доступом. Перед выполнением аблативной операции необходима биопсия опухоли. Контроль процедуры производится путем визуализации зоны воздействия с помощью камеры, введенной в брюшную полость, или лучевой навигации (УЗИ, КТ или МРТ). В опухоль вводятся зонды, обеспечивающие охлаждение/оттаивание при криоаблации или перегревание при РЧА.
Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Комментарий: конвенционная лучевая терапия неэффективна при ПКР. Роль СТЛТ в лечении метастазов рака почки изучена недостаточно, в связи с чем рекомендуется только при метастазировании в головной мозг (см. ниже).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий (доказательная база): в исследовании, включившем 88 пациентов ПКР с метастазами в головной мозг, сравнивали СТЛТ, облучение всего головного мозга и их комбинацию. СТЛТ обеспечивала бóльшую частоту интрацеребрального контроля над опухолью и ОВ. Дополнительное облучение всего головного мозга после СТЛТ не увеличивало частоту локального контроля и 2-летнюю ОВ [162].
В другом исследовании сравнивали фракционированную СТЛТ и удаление метастазов из головного мозга с последующей его лучевой терапией. Выживаемость пациентов, получавших СТЛТ, была недостоверно выше, чем в хирургической группе; частота локального контроля в лечебных группах была одинаковой [163].
Показания: солитарные или единичные метастазы в головном мозге у пациентов без экстракраниальных метастазов или с возможностью контроля метастазов других локализаций с помощью лекарственной противоопухолевой терапии.
Цель: длительный контроль над интракраниальными метастазами и ликвидация или снижение интенсивности обусловленных ими неврологических симптомов.
Уровень убедительности рекомендаций – B (уровень достоверности доказательств − 2).
Комментарий (доказательная база): в исследовании, сравнивавшем однократное облучение (в суммарной очаговой дозе >24 Гр) и гипофракционное облучение пациентов с ПКР с метастазами в кости, отмечено достоверное увеличение 3-летней выживаемости без местного прогрессирования в группе, получившей лучевую терапию в 1 фракции [164]. В другой серии наблюдений сравнивали СТЛТ и конвенционную лучевую терапию у пациентов с метастазами ПКР в позвоночник. Выраженность болей, частота объективных ответов (ЧОО), время до снижения интенсивности болей в группах не различались [165].
Показания: интенсивные костные боли, обусловленные метастазами, у пациентов с ПКР.
Цель: снизить интенсивность болей и улучшить качество жизни.
Принципы: СТЛТ не является методом контроля над опухолью и должна быть дополнена системной противоопухолевой терапией.
ПКР – гетерогенная группа новообразований, исходящих из коркового слоя почки, составляющая около 90 % всех опухолей данной локализации. В настоящее время выделено несколько вариантов рака паренхимы почки, характеризующихся специфическими молекулярно-генетическими особенностями, среди которых доминирует светлоклеточный тип (сПКР) (80 %); гораздо реже встречаются несветлоклеточные варианты рака паренхимы почки (нПКР) (папиллярный (10−15 %), хромофобный (5 %) и редкие разновидности ПКР (<1 %)). Поэтому сПКР был выбран в качестве основного объекта для изучения особенностей туморогенеза и поиска потенциальных мишеней для системного противоопухолевого лечения.
Поиск эффективных режимов терапии ПКР долго был безрезультатным в связи с химиорезистентностью данной опухоли, обусловленной гиперэкспрессией белка множественной лекарственной устойчивости. Рак паренхимы почки – иммуногенная опухоль, и до 2005 г. стандартным подходом к лечению неоперабельных местно-распространенных и диссеминированных форм заболевания являлась цитокиновая иммунотерапия (интерферон альфа-2b** (ИФН-α**), интерлейкин-2), ассоциированная с низкой ЧОО и короткой беспрогрессивной выживаемостью (БПВ) [166]. Популяция пациентов с ПКР прогностически разнородна. По данным MSKCC прогноз пациентов, получающих цитокиновую терапию, определяется количеством независимых факторов риска ОВ (соматический статус, время от диагноза до лечения, уровни гемоглобина, лактатдегидрогеназы и скорректированного по альбумину кальция), и все пациенты могут быть разделены на группы хорошего (0 факторов), промежуточного (1−2 фактора) и плохого (>2) прогноза [14].
Изучение специфики путей внутриклеточной передачи сигнала при сПКР позволило разработать антитела к VEGF (бевацизумаб**) и тирозинкиназным доменам рецепторов VEGF и других ростовых факторов (TKI) (сунитиниб**, пазопаниб**, сорафениб**, акситиниб**, ленватиниб**, кабозантиниб**), а также препараты, ингибирующие mTOR (темсиролимус, эверолимус**), которые начали входить в стандарты лечения распространенного сПКР с 2005 г. Анализ данных 645 получавших таргетную терапию пациентов, проведенный IMDC, позволил разработать прогностическую шкалу, основанную на наличии и количестве факторов риска ОВ (уровни гемоглобина, скорректированного по альбумину кальция, нейтрофилов и тромбоцитов, соматический статус и время от диагноза до лечения). Пациенты, не имеющие (0) факторов риска, относятся к группе хорошего, 1−2 фактора – промежуточного и >2 факторов – плохого прогноза [15]. В настоящее время именно данная классификация является одним из основных критериев выбора лечебной тактики.
Дальнейшие исследования привели к разработке эффективных режимов, основанных на иммуноонкологических препаратах, способных точечно блокировать межклеточную передачу противоиммуногенного сигнала (ингибировать рецептор программируемой клеточной смерти 1-го типа (PD-1) (ниволумаб**, пембролизумаб**) или его лиганд 1-го типа (PD-L1) (авелумаб**) и CTLA-4 (ипилимумаб**)).
Результаты последних исследований, продемонстрировавших увеличение ОВ больных сПКР, получавших новые режимы терапии, по сравнению с предшествующим стандартом привели к коренному пересмотру клинических рекомендаций.
Рекомендации по назначению и применению указанных ниже лекарственных препаратов представлены в подразделе 3.4.2.
1. Антиангиогенные препараты
a. Моноклональные антитела (антитела к VEGF)
i. Бевацизумаб**
Бевацизумаб** − гуманизированные антитела, связывающие изоформы VEGF-A. Доза #бевацизумаба** 10 мг/кг в/в капельно 1 раз в 2 нед. Препарат назначается в сочетании с ИФН-α** с постепенной эскалацией дозы последнего от 3 млн ЕД 3 раза в нед подкожно в течение 1-й недели терапии, до 6 млн ЕД 3 раза в нед подкожно в течение 2-й недели терапии и до 9 млн ЕД 3 раза в нед подкожно в течение 3-й и последующих нед терапии. При плохой переносимости ИФН-α** разовая доза его может быть снижена до 6 млн ЕД или 3 млн ЕД.
b. Ингибиторы протеинкиназы (мультикиназные ингибиторы)
i. Сорафениб**
Сорафениб** – пероральный мультикиназный ингибитор, угнетающий активность серин-треониновой киназы Raf-1, B-Raf, рецепторов VEGF 2-го типа (VEGFR2) и PDGF (PDGFR), FMS-подобной тирозинкиназы-3 и c-KIT. Препарат назначается в монорежиме, суточная доза составляет 800 мг (4 таблетки по 200 мг). Она назначается в 2 приема (2 таблетки 2 раза в сутки). При необходимости доза препарата может быть снижена до 400 мг 1 раз в сутки или до 400 мг через день.
ii. Сунитиниб**
Сунитиниб** – пероральный мультикиназный ингибитор ростовых факторов PDGFR, VEGFR, с-KIT и FMS-подобной тирозинкиназы 3, обладающий противоопухолевой и антиангиогенной активностью. Препарат назначается в монорежиме, его доза составляет 50 мг/сут в течение 4 нед с последующим перерывом в течение 2 нед (режим 4/2). Полный цикл терапии составляет 6 нед. При необходимости доза препарата может быть снижена на 12,5 мг, до 37,5 мг/сут. У пациентов с плохой индивидуальной переносимостью режима 4/2 допустимо назначение сунитиниба** в дозе 50 мг/сут в течение 2 нед с последующим перерывом в течение 1 нед (режим 2/1).
iii. Пазопаниб**
Пазопаниб** − пероральный селективный ингибитор тирозинкиназ, VEGFR, PDGFR и c-KIT. Препарат назначается в монорежиме, его доза составляет 800 мг 1 раз в сутки. При необходимости суточная доза препарата может быть уменьшена или увеличена с шагом 200 мг, при этом максимальная суточная доза не должна превышать 800 мг и минимальная суточная доза не должна быть ниже 400 мг.
iv. Акситиниб**
Акситиниб** – пероральный высокоаффинный ингибитор тирозинкиназ, блокирующий VEGFR1–3. Препарат назначается в монорежиме или в комбинации с ингибиторами PD(L)-1 (пембролизумаб** 200 мг 1 раз в 3 нед или 400 мг 1 раз в 6 нед или #авелумаб** 10 мг/кг или авелумаб** 800 мг 1 раз в 2 нед). Как при назначении монотерапии акситинибом**, так и при использовании комбинаций на основе данного препарата начальная доза акситиниба** составляет 5 мг 2 раза в сутки с интервалом между приемами 12 ч. Пациентам, переносящим препарат в начальной дозе (5 мг 2 раза в сутки) без развития нежелательных явлений (НЯ) выше II степени тяжести согласно Общим критериям оценки степени тяжести нежелательных явлений (Common Terminology Criteria for Adverse Events, CTCAE) в течение 2 последовательных недель, при условии, что артериальное давление не превышает 150/90 мм рт. ст. и нет необходимости в приеме стандартной гипотензивной терапии, возможно повышение дозы до 7 мг 2 раза в сутки. Затем с использованием тех же критериев пациентам, переносящим акситиниб** в дозе 7 мг 2 раза в сутки, возможно дальнейшее повышение дозы препарата до максимальной ‒ 10 мг 2 раза в сутки. При необходимости допускается снижение дозы акситиниба** до 3 мг 2 раза в сутки, затем – до 2 мг 2 раза в сутки.
v. Ленватиниб**
Ленватиниб** – пероральный мультикиназный ингибитор FGFR1–4, VEGFR1–3, PDGFR-α, а также рецепторов RET, KIT. Суточная доза ленватиниба** зависит от состава назначаемой комбинации.
В комбинации с эверолимусом** 5 мг/сут суточная доза ленватиниба** составляет 18 мг (1 капсула 10 мг и 2 капсулы 4 мг) 1 раз в сутки. При необходимости суточная доза препарата может быть уменьшена или увеличена с шагом 4 мг, при этом максимальная суточная доза не должна превышать 18 мг, а минимальная суточная доза не должна быть ниже 10 мг.
В комбинации с пембролизумабом** 200 мг 1 раз в 3 нед или 400 мг 1 раз в 6 нед суточная доза ленватиниба** составляет 20 мг (2 капсулы 10 мг) 1 раз в сутки. При необходимости суточная доза препарата может быть уменьшена или увеличена с шагом 4 мг, при этом максимальная суточная доза не должна превышать 20 мг, а минимальная суточная доза не должна быть ниже 10 мг.
vi. Кабозантиниб**
Кабозантиниб** – пероральный мультикиназный ингибитор VEGFR1–3, AXL, MET (рецептор фактора роста гепатоцитов), а также RET, рецепторов факторов роста стволовых клеток KIT, FLT3, ROS1, MER, TYRO3, TRKB и TIE-2. При назначении монотерапии кабозантинибом** суточная доза составляет 60 мг 1 раз в сутки. При необходимости доза препарата может быть уменьшена или увеличена с шагом 20 мг, при этом максимальная суточная доза не должна превышать 60 мг и минимальная суточная доза не должна быть ниже 20 мг.
При назначении в комбинации с ниволумабом** 240 мг 1 раз в 2 нед или 480 мг 1 раз в 4 нед суточная доза кабозантиниба** составляет 40 мг 1 раз в сутки. При необходимости доза препарата может быть уменьшена до 20 мг.
2. Селективные иммунодепрессанты, ингибирующие mTOR
a. Эверолимус**
Эверолимус** – пероральный ингибитор mTOR, блокирующий белковый комплекс TORC-1. Препарат назначается как в монорежиме, так и в комбинации с ленватинибом**. Рекомендуемая доза для монотерапии составляет 10 мг 1 раз в сутки. При необходимости доза препарата может быть снижена до 5 мг/сут.
В комбинации с ленватинибом** эверолимус** назначается в дозе 5 мг/сут. Редукция дозы не предусмотрена.
b. Темсиролимус
Темсиролимус – ингибитор mTOR, блокирующий белковый комплекс TORC-1. Доза темсиролимуса − 25 мг в/в капельно в течение 30–60 мин 1 раз в нед. При необходимости доза препарата может быть снижена на 5 мг в нед.
3. Иммуномодуляторы
a. Иммуностимуляторы: интерфероны
i. ИФН-α**
ИФН-α** – провоспалительный цитокин, назначается в комбинации с #бевацизумабом**. ИФН-α** назначается в стартовой дозе 3 млн ЕД 3 раза в нед подкожно в течение 1-й недели терапии. При отсутствии тяжелых НЯ доза повышается до 6 млн ЕД 3 раза в нед подкожно в течение 2-й недели терапии и до 9 млн ЕД 3 раза в нед подкожно в течение 3-й и последующих недели терапии. При плохой переносимости ИФН-α** разовая доза препарата может быть снижена до 6 млн ЕД или 3 млн ЕД.
b. Ингибиторы PD-1
i. Ниволумаб**
Ниволумаб** – моноклональное антитело к PD-1. Препарат может назначаться в монорежиме или в составе комбинаций с ипилимумабом** или кабозантинибом**.
В качестве монотерапии ниволумаб** вводится в дозе 3 мг/кг или 240 мг каждые 2 нед или 480 мг каждые 4 нед в/в в виде 30-минутной или 60-минутной инфузии.
В комбинации с ипилимумабом** ниволумаб** вводится в дозе 3 мг/кг с последующим введением ипилимумаба** в дозе 1 мг/кг в тот же день в виде 30-минутной в/в инфузии, каждые 3 нед, всего 4 введения. Далее проводится монотерапия препаратом ниволумаб** в дозе 3 мг/кг или 240 мг – 1-е введение через 3 нед после последнего совместного введения, далее каждые 2 нед или в дозе 480 мг – 1-е введение через 6 нед после последнего совместного введения, далее каждые 4 нед.
В комбинации с кабозантинибом** 40 мг/сут ниволумаб** назначается в дозе 240 мг каждые 2 нед или 480 мг каждые 4 нед в/в капельно.
Редукция дозы ниволумаба** не предусмотрена.
ii. Пембролизумаб**
Пембролизумаб** – моноклональное антитело к PD-1. Препарат может использоваться в составе комбинаций с #акситинибом** (5 мг 2 раза в сутки) или ленватинибом** (20 мг/сут). Пембролизумаб** назначается в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед. Редукция дозы пембролизумаба** не предусмотрена.
c. Ингибиторы PD-L1
i. Авелумаб**
Авелумаб** – человеческий иммуноглобулин G1 (IgGl), моноклональное антитело, направленное против PD-L1. Препарат назначается в дозе 800 мг в/в капельно в течение 1 ч 1 раз в 2 нед или в эквивалентной дозировке согласно инструкции по применению в комбинации с #акситинибом** 5 мг 2 раза в сутки перорально. Редукция дозы авелумаба** не предусмотрена.
d. Ингибиторы CTLA-4
i. Ипилимумаб**
Ипилимумаб** – моноклональное тело к CTLA-4. Рекомендуемая доза ипилимумаба** − 1 мг/кг в/в капельно 1 раз в 3 нед, 4 введения. Назначается в комбинации с ниволумабом** в дозе 3 мг/кг или #ниволумабом** 240 мг 1 раз в 3 нед в/в капельно, 4 введения. Далее проводится монотерапия препаратом ниволумаб** в дозе 3 мг/кг или 240 мг – 1-е введение через 3 нед после последнего совместного введения, далее каждые 2 нед или в дозе 480 мг – 1-е введение через 6 нед после последнего совместного введения, далее каждые 4 нед. Редукция дозы ипилимумаба** не предусмотрена.
Уровень убедительности рекомендаций − C (уровень достоверности доказательств – 4).
Комментарий: (доказательная база): неоадъювантная таргетная терапия при клинически локализованном и местно-распространенном ПКР направлена на уменьшение размеров первичной опухоли для увеличения шансов выполнить органосохраняющее вмешательство или радикально удалить почку с опухолью. В ряде серий наблюдений и рандомизированных исследованиях продемонстрировано уменьшение размеров опухолевых узлов на фоне неоадъювантного лечения TKI [168, 169]. Однако группы пациентов, получавших таргетную терапию до операции, малы, а клинические исследования включали небольшое число больных и относились ко II фазе испытаний. Ингибиторы иммунных контрольных точек в неоадъювантном режиме не изучены. Для подтверждения эффективности и безопасности данной лечебной тактики необходимы крупные рандомизированные исследования.
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 1).
Комментарий (доказательная база): проведение адъювантной терапии цитокинами пациентам после РН не способствует улучшению их выживаемости. Адъювантная терапия #ИФН-α** у радикально оперированных пациентов с неметастатическим ПКР не оказывала влияния на БРВ и ОВ по данным 2 рандомизированных исследований [172, 173]. Целесообразность проведения адъювантной терапии таргетными препаратами изучали в нескольких рандомизированных исследованиях, однако ни в одном из них не было продемонстрировано преимуществ как в ОВ, так и в БПВ. Только в 1 из 4 рандомизированных исследований, сравнивавших адъювантную терапию TKI и наблюдение, была достигнута первичная цель. В исследовании S-TRAC продемонстрировано достоверное увеличение БРВ у радикально оперированных пациентов с ПКР группы высокого риска прогрессирования, получавших адъювантную терапию сунитинибом**, по сравнению с плацебо [174]. Однако ранее опубликованное исследование ASSURE не подтвердило увеличение БРВ и ОВ при использовании адъювантной терапии сунитинибом** или сорафенибом** по сравнению с плацебо [175]. Коренные различия данных 2 рандомизированных исследований, а также отрицательные результаты рандомизированных исследований пазопаниба** и акситиниба** в адъювантном режиме наряду с отсутствием преимуществ ОВ во всех исследованиях и высокой частотой НЯ, ассоциированных с терапией сунитинибом**, ставят под сомнение целесообразность и безопасность использования адъювантной антиангиогенной терапии [176, 177].
Исследования терапии 1-й линии
В 2 рандомизированных исследованиях III фазы, сравнивавших комбинацию #бевацизумаба** и ИФН-α** с монотерапией ИФН-α** в 1-й линии терапии распространенного сПКР у пациентов групп благоприятного и промежуточного прогноза MSKCC, перенесших нефрэктомию, было продемонстрировано преимущество БПВ в группе комбинированного лечения (8,4 мес против 4,9 мес и 10,4 мес против 5,5 мес соответственно) [178, 179]. Однако ни в одном протоколе достоверного различия в показателях ОВ между группами отмечено не было. Терапия бевацизумабом** была ассоциирована с развитием НЯ, свойственных антиангиогенным препаратам, таких как слабость (76 %) и АГ (13 %). Специфичным для бевацизумаба** НЯ оказалась протеинурия (22 %) [179].
В исследовании III фазы, сравнивавшем сунитиниб** и ИФН-α** в 1-й линии терапии диссеминированного сПКР у пациентов групп благоприятного и промежуточного прогноза MSKCC после удаления первичной опухоли, было продемонстрировано достоверное преимущество сунитиниба** в отношении времени до прогрессирования (11 и 5 мес соответственно; p <0,000 001). Показатели ОВ в группах не достигли статистически значимых различий (26,4 и 21,8 мес соответственно; p = 0,05). Помимо АГ (24 %), диареи (53 %) и ладонно-подошвенного синдрома (20 %) терапия сунитинибом** оказалась ассоциирована с несколько бóльшим риском развития гематологической токсичности, чем при использовании другой антиангиогенной терапии (нейтропения – 37 %) [180].
Пазопаниб** сравнивали с плацебо в рандомизированном исследовании III фазы, включившем пациентов с распространенным сПКР групп промежуточного и хорошего прогноза MSKCC, перенесших нефрэктомию с терапией #ИФН-α** или без нее. В группе пазопаниба** было достигнуто достоверное преимущество БПВ по сравнению с группой плацебо как у пациентов, ранее не получавших терапии (11,1 и 2,8 мес соответственно), так и у пациентов с опухолями, резистентными к цитокинам (9,2 и 4,2 мес соответственно) [181]. Назначение пазопаниба** не увеличивало ОВ. Терапия пазопанибом** была ассоциирована с развитием характерных для TKI НЯ, таких как диарея (63 %), слабость (55 %) и АГ (46 %). Специфичным НЯ, ассоциированным с терапией пазопанибом**, являлась печеночная токсичность (элевация активности аланинаминотрансферазы – 31 %) [182].
Темсиролимус изучали в рандомизированном исследовании III фазы в 1-й линии терапии пациентов с распространенным, преимущественно сПКР, группы плохого прогноза, перенесших нефрэктомию. Пациентов рандомизировали в 3 группы, получавшие темсиролимус, #ИФН-α** или их комбинацию. В группе пациентов, получавших только темсиролимус, БПВ была выше по сравнению с пациентами, получавшими #ИФН-α** или комбинацию препаратов (5,5, 3,1 и 4,7 мес соответственно). Монотерапия темсиролимусом также обеспечивала преимущество ОВ по сравнению с #ИФН-α** и комбинированной терапией (10,9, 7,3 и 8,4 мес соответственно). Терапия темсиролимусом была ассоциирована с развитием ряда НЯ, характерных для ингибиторов mTOR, таких как стоматит (20 %), инфекция (27 %) и пульмониты (2 %); среди специфических лабораторных отклонений следует отметить анемию (45 %), гипергликемию (27 %) и гиперлипидемию (24 %) [183]. Открытое рандомизированное клиническое исследование II фазы CABOSUN (n = 157) было направлено на изучение сравнительной эффективности и безопасности кабозантиниба** и сунитиниба** в 1-й линии терапии диссеминированного сПКР у пациентов групп плохого и промежуточного прогноза IMDC. Кабозантиниб** достоверно увеличивал БПВ по сравнению с сунитинибом** (8,6 мес против 5,3 мес соответственно). ЧОО достигла 20 % в группе кабозантиниба** и 9 % в группе сунитиниба**. Все подтвержденные объективные ответы были частичными. При медиане наблюдения 30,8 мес медиана ОВ достоверно не различалась между группами, хотя оказалась несколько выше в группе кабозантиниба** по сравнению с сунитинибом** (26,6 мес против 21,2 мес соответственно). Частота НЯ III−IV степеней тяжести была сопоставима между группами кабозантиниба** и сунитиниба** (68 и 65 % соответственно). Редукция дозы кабозантиниба** (58 %) требовалась чаще, чем дозы сунитиниба** (49 %), однако отмена лечения вследствие тяжелой токсичности была показана равной доле пациентов в обеих группах (21 и 22 % соответственно) [184].
Ниволумаб** в комбинации с ипилимумабом** сравнивали с сунитинибом** в 1-й линии терапии распространенного сПКР в рандомизированном исследовании III фазы CheckMate 214, первичными целями которого являлись ОВ, БПВ и ЧОО у пациентов групп промежуточного и плохого прогноза IMDC. У данной категории больных при медиане наблюдения 48 мес комбинированная иммунотерапия продемонстрировала достоверное преимущество ОВ (медиана 48,1 и 26,6 мес соответственно), БПВ (медиана 11,2 и 8,3 мес соответственно) и ЧОО (42 и 27 %, включая полный ответ у 10,4 и 1,4 % больных соответственно) по сравнению с группой контроля. У подгруппы больных с саркоматоидной дифференцировкой опухоли комбинация обеспечивала значимое преимущество ОВ (р = 0,0004) и БПВ (р = 0,0093) по сравнению с сунитинибом** [185]. НЯ, ассоциированные с комбинированной иммунотерапией или монотерапией сунитинибом**, были зарегистрированы у 94 и 97,4 %, достигли III−IV степеней тяжести у 48 и 64 %, являлись поводом для отмены лечения у 22 и 12 % и были сочетаны с причиной смерти 8 и 4 пациентов соответственно [186].
Пембролизумаб** в комбинации с #акситинибом** сравнивали с сунитинибом** в 1-й линии терапии распространенного сПКР в рамках рандомизированного исследования III фазы KEYNOTE-426. Комбинированная терапия обеспечивала убедительное преимущество ОВ (медиана 45,7 и 40,1 мес соответственно; р <0,001), БПВ (медиана 15,7 и 11,1 мес соответственно; р <0,0001) по сравнению с сунитинибом**. Различия выживаемости достигли статистической значимости в группах промежуточного и плохого прогноза. ЧОО в группе пембролизумаба** с #акситинибом** оказалась значимо выше, чем в группе контроля (60,4 и 39,6 %, включая полный ответ у 10,0 и 3,5 % больных соответственно). У подгруппы больных с саркоматоидной дифференцировкой опухоли комбинация по сравнению с сунитинибом** обеспечивала значимое преимущество ЧОО (58,8 и 31,5 %), БПВ (медиана не достигнута и 8,4 мес), но не ОВ. НЯ регистрировали в группах комбинации и сунитиниба** с одинаковой частотой (96,3 и 97,6 % соответственно), включая НЯ III−V степеней тяжести (62,9 и 58,1 % соответственно). Наиболее частыми тяжелыми НЯ, ассоциированными с терапией пембролизумабом** и #акситинибом**, являлись АГ, элевация активности трансаминаз и диарея [187].
Авелумаб** в комбинации с #акситинибом** сравнивали с сунитинибом** в 1-й линии терапии распространенного сПКР в рамках рандомизированного исследования III фазы JAVELIN Renal 101. Первичными целями являлись БПВ и ОВ у больных с PD-L1-позитивными опухолями (PD-L1+), вторичными – БПВ и ОВ у всех пациентов. По данным промежуточного анализа комбинированная терапия обеспечивала значимое преимущество БПВ как у больных с опухолями PD-L1+ (ОР 0,61; 95 % ДИ 0,48–0,79), так и во всей популяции исследования (медиана БПВ 13,8 и 8,4 мес соответственно; ОР 0,69; p = 0,0002). При медиане наблюдения 19 мес частота смертей составила 27 %, и данные по ОВ являются незрелыми. ЧОО в группе комбинации достигла 51,4 %, что превышает 25,7 % в группе сунитиниба**. У больных с саркоматоидным компонентом в опухоли авелумаб** с #акситинибом** по сравнению с сунитинибом** значимо увеличивали БПВ и ЧОО [188]. Наиболее частыми НЯ у больных, получавших авелумаб** с #акситинибом**, являлись диарея (62 %), слабость (53 %), гипертензия (50%), костно-мышечная боль (40 %), тошнота (34 %), мукозиты (34 %), ладонно-подошвенный синдром (33 %) и дисфония (31 %). Чаще всего III–IV степеней тяжести достигали АГ (26 %) гепатотоксичность (9 %) и диарея (8 %) [189].
Пембролизумаб** в комбинации с ленватинибом** и ленватиниб** в комбинации с эверолимусом** сравнивали с сунитинибом** в 1-й линии терапии распространенного сПКР в рандомизированном исследовании III фазы KEYNOTE-581/CLEAR. Первичной целью исследования являлась БПВ, вторичными – ОВ и ЧОО. БПВ была значимо выше в группе больных, получавших пембролизумаб** c ленватинибом**, по сравнению с пациентами, получавшими сунитиниб** (медиана 23,9 и 9,2 мес соответственно; р <0.001), а также в группе больных, получавших ленватиниб** в комбинации с эверолимусом**, по сравнению с пациентами, получавшими сунитиниб** (медиана 14,7 и 9,2 мес соответственно; р <0.001). ОВ оказалась выше при использовании пембролизумаба** c ленватинибом** по сравнению с назначением сунитиниба** (р = 0,005); различия результатов между группами ленватиниба** с эверолимусом** и сунитиниба** не достигли статистической значимости (р = 0,30). ЧОО была значимо выше у больных, получавших комбинации пембролизумаба** c ленватинибом** (71 %) и ленватиниба** с эверолимусом** (53,5 %), по сравнению с пациентами, получавшими сунитиниб** (36,1 %) (р <0,0001 для всех). Наиболее частыми НЯ у больных, получавших пембролизумаб** c ленватинибом**, являлись диарея (61,4 %), гипертензия (55,4 %), гипотиреоз (47,2 %), снижение аппетита (40,3 %), слабость (40,1 %) и тошнота (35,8 %). НЯ достигли III степени тяжести и выше у 82,4 % пациентов данной группы [190].
Ниволумаб** в комбинации с кабозантинибом** сравнивали с сунитинибом** в 1-й линии терапии сПКР в рамках рандомизированного исследования III фазы CheckMate 9ER, первичной конечной точкой которого являлась БПВ, вторичными – ОВ и ЧОО. При медиане наблюдения 18,1 мес медиана БПВ составила 16,6 мес в группе комбинации и 8,3 мес в группе сунитиниба** (р <0,001); 12-месячная ОВ достигла 85,7 и 75,6 % соответственно (р = 0,001). Объективный ответ был зарегистрирован у 55,7 % больных, получавших ниволумаб** с кабозантинибом**, и у 27,1 % пациентов, которым назначалcя сунитиниб** (р <0,001). У больных с саркоматоидным компонентом в опухоли ниволумаб** с кабозантинибом** по сравнению с сунитинибом** значимо увеличивали ОВ, БПВ и ЧОО. НЯ III степени тяжести и выше отмечены у 75,3 % больных в группе комбинации. Наиболее распространенными видами токсичности, ассоциированными с терапией ниволумабом** с кабозантинибом**, являлись диарея (57 %), ладонно-подошвенный синдром (38 %), гипотиреоз (33 %), АГ (30 %) и слабость (27 %); самыми частыми тяжелыми НЯ – АГ (11 %), ладонно-подошвенный синдром (8 %) и диарея (6 %) [191].
Исследования 2-й линии терапии
Пазопаниб** и сорафениб** продемонстрировали преимущество БПВ по сравнению с плацебо в рандомизированных исследованиях III фазы, сунитиниб** – в исследовании II фазы [181, 192, 193].
В исследовании III фазы сравнивали эффективность применения сорафениба** и плацебо после прогрессирования, отмеченного на фоне проведения предшествующей системной иммунотерапии. БПВ в группе сорафениба** оказалась достоверно выше, чем в группе плацебо (5,5 и 2,8 мес соответственно), что транслировалось в статистически незначимое увеличение ОВ (17,8 и 14,3 мес соответственно). Сорафениб** чаще, чем другие антиангиогенные препараты, вызывал развитие кожной токсичности (ладонно-подошвенный синдром – 33 %, сыпь – 28 %, алопеция – 27 %) [192].
Эверолимус** сравнивали с плацебо во 2-й и последующих линиях терапии сПКР, резистентного к предшествующему антиангиогенному лечению, в рандомизированном исследовании III фазы RECORD-1. Эверолимус** продемонстрировал преимущество БПВ по сравнению с плацебо (4,9 и 1,9 мес соответственно) во всех подгруппах пациентов независимо от количества линий и вида предшествующей терапии, но не влиял на ОВ. Специфическими НЯ на фоне терапии эверолимусом** являлись стоматит (42 %), инфекция (13 %), пульмонит (14 %) и такие лабораторные отклонения, как гипергликемия (8 %) и гиперлипидемия (18 %) [194].
В рандомизированном исследовании III фазы AXIS акситиниб** обеспечивал значимо бóльшую БПВ, чем сорафениб**, у пациентов, ранее получавших #ИФН-α** (12,1 и 6,5 мес соответственно) и сунитиниб** (6,7 и 4,7 мес соответственно), не давая достоверного выигрыша у немногочисленных пациентов, которым ранее назначались #бевацизумаб** с ИФН-α** и темсиролимус. Акситиниб** чаще всего вызывал развитие таких НЯ, как АГ (40 %), диарея (55 %), слабость (39 %); отмечена возможность кумулятивной токсичности последовательной терапии TKI [195].
В исследовании III фазы METEOR, включившем больных распространенным ПКР, прогрессирующим на фоне или после 1 и более линий VEGF-таргетной терапии, кабозантиниб** сравнивали с эверолимусом**. ЧОО в группах кабозантиниба** и эверолимуса** составила 17 и 3 % соответственно. Кабозантиниб** продемонстрировал убедительное увеличение БПВ (7,4 и 3,8 мес соответственно; р <0,0001), которое транслировалось в преимущество ОВ (21,4 и 16,5 мес соответственно; р <0,001). Частота НЯ в группах кабозантиниба** и эверолимуса** не различалась (100 и 99 % соответственно). Наиболее частыми тяжелыми НЯ на фоне терапии кабозантинибом** были АГ (15 %), диарея (13 %) и слабость (11 %); редукция дозы кабозантиниба** потребовалась в 60 %, прекращение лечения из-за НЯ – в 9,1 % случаев [196].
Рандомизированное исследование II фазы 205 включило 153 пациентов со сПКР, прогрессирующим после 1 линии антиангиогенной терапии, рандомизированных в 3 лечебных группы, в которых назначали ленватиниб**, эверолимус** или ленватиниб** в комбинации с эверолимусом**. Комбинированная таргетная терапия обеспечивала достоверное преимущество БПВ (14,6 мес) по сравнению с монотерапией ленватинибом** (7,4 мес) и эверолимусом** (5,5 мес). Различия БПВ привели к увеличению ОВ в группе комбинированного лечения по сравнению с монотерапией ленватинибом** и эверолимусом** (25,5, 19,1 и 15,4 мес соответственно). Частота НЯ на фоне комбинированной таргетной терапии составила 74,5 % при частоте осложнений III−IV степеней тяжести, достигшей 35,3 %. Профиль токсичности ленватиниба** с эверолимусом** в исследовании 205 был комбинированным и включал НЯ, свойственные как TKI, так и блокаторам mTOR [197].
Ниволумаб** сравнивали с эверолимусом** во 2-й линии терапии распространенного сПКР, резистентного к антиангиогенной терапии, в рамках рандомизированного исследования III фазы CheckMate 025. Ниволумаб** достоверно увеличивал ОВ (15,8 и 19,7 мес соответственно; р = 0,0005) и ЧОО (21,5 и 3,9 % соответственно; р <0,0001) по сравнению с эверолимусом**, не оказывая влияния на БПВ (4,6 и 4,4 мес соответственно; р = 0,11). Преимущество ОВ в группе иммунотерапии не зависело от статуса PD-L1. Наиболее частыми НЯ, ассоциированными с терапией ниволумабом**, являлись слабость (33 %), тошнота (14 %), зуд (14 %), диарея (12 %) и снижение аппетита (12 %) [198].
Наиболее распространенным вариантом нПКР является папиллярный рак 1 и 2-го типов. Лекарственная терапия нПКР не изучалась в рандомизированных исследованиях III фазы. В программах расширенного доступа было показано, что прогноз пациентов с нПКР хуже, чем у пациентов со светлоклеточными опухолями.
В рандомизированном исследовании II фазы SWOG 1500, сравнивавшем три MET-ингибитора, включая кабозантиниб**, с сунитинибом** при папиллярном ПКР, только кабозантиниб** продемонстрировал значимое преимущество в показателях БПВ по сравнению с сунитинибом** (9,2 и 5,6 мес соответственно; р = 0,02) [199].
Пембролизумаб** показал умеренную эффективность при нПКР в когорте В исследования II фазы KEYNOTE-427, включившем 165 больных (папиллярным ПКР – 71,5 %, хромофобным ПКР – 12,7 % и неклассифицируемым ПКР – 15,8 %). ЧОО у всех пациентов составила 26,7 %, медиана длительности ответа – 29,0 мес. ЧОО у пациентов с папиллярным ПКР достигла 28,8 %, хромофобным ПКР – 9,5 % и неклассифицируемым ПКР – 30,8 %. Медиана БПВ всех больных равнялась 4,2 мес, ОВ – 28,9 мес [200].
Ниволумаб** в комбинации с ипилимумабом** изучались при нПКР в когорте 2 исследования II фазы CheckMate 920, включившей 50 больных (неклассифицируемым ПКР – 42,3 %, папиллярным ПКР – 34,6 %, хромофобным ПКР – 13,5 %, другими вариантами нПКР – 9,6 %). ЧОО у всех пациентов составила 19,6 %, медиана БПВ – 3,7 мес, медиана ОВ – 21,2 мес [201].
Имеются данные об эффективности темсиролимуса, эверолимуса**, сунитиниба** и сорафениба** при нПКР [183, 202−204]. В исследовании RAPTOR медиана БПВ у пациентов с папиллярным ПКР 1 и 2-го типов, получавших эверолимус**, составила 3,7 мес [205]. В рандомизированном исследовании II фазы ESPN (n = 73), сравнивавшем эверолимус** и сунитиниб** при нПКР, медиана БПВ в группах составила 4,1 и 6,1 мес соответственно (p >0,05). На основании результатов систематического анализа, включившего данные исследований ESPN, RECORD-3 и ASPEN, сунитиниб** и − в меньшей степени – эверолимус** могут являться допустимыми опциями для лечения этой группы пациентов [206].
Результаты ключевых исследований, определяющих алгоритм выбора терапии у больных ПКР, консолидированы в табл. 3.
Таблица 3. Результаты ключевых исследований лекарственной терапии при ПКР
| Препарат | Препарат в группе контроля | Название клинического исследования | Автор | Первичная цель | N пациентов | БПВ | ОВ | ЧОО, % | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Медиана, мес | ОР (95 % ДИ) | Медиана, мес | ОР (95 % ДИ) | ||||||||||||
| Группа исследования | Группа контроля | Группа исследования | Группа контроля | Группа исследования | Группа контроля | ||||||||||
| 1-я линия | |||||||||||||||
| Сунитиниб** | #ИФН-α** | − | Motzer 2007, 2009 | БПВ | 750 | 11 | 5 | 0,42 (0,32–0,54) | 26,4 | 21,8 | 0,82 (0,67–1,00) | 31 | 6 | ||
| #Бевацизумаб** + ИФН-α** | AVOREN | Escudier 2007, 2010 | БПВ | 649 | 10.2 | 5,4 | 0,61 (0,51–0,73) | 23,3 | 21,3 | 0,86 (0,72–1,04) | 31 | 13 | |||
| Пазопаниб** | Плацебо | VEG105192 | Sternberg 2010, 2013 | БПВ | 435 | 9,2 | 4,2 | 0,46 (0,34–0,62) | 22,9 | 20,5 | 0,91 (0,71–1,16) | 30 | 3 | ||
| Пазопаниб** | Сунитиниб** | COMPARZ | Motzer 2013, 2014 | БПВ | 1110 | 8,4 | 9,5 | 1,05 (0,99–1,02) | 28,3 | 29,3 | 0,92 (0,79–1,06) | 31 | 25 | ||
| Темсиролимус | #ИФН-α** | Global ARCC | Hudes 2007 | ОВ | 626 | 5,5 | 3,1 | 0,66 (0,53–0,81) | 10,9 | 7,3 | 0,73 (0,58–0,92) | 8,6 | 4,8 | ||
| #Бевацизумаб** + ИФН-α** | #ИФН-α** | CALGB 90 206 | Rini 2008, 2010 | ОВ | 732 | 8,5 | 5,2 | 0,71 (0,61–0,83) | 18,3 | 17,4 | 0,86 (0,73–1,01) | 26 | 13 | ||
| Кабозантиниб** | Сунитиниб** | CABOSUN | Choueiri 2017 | БПВ | 157 | 8,6 | 5,3 | 0,48 (0,31–0,74) | 26,6 | 21,2 | 0,79 (0,53–1,2) | 20 | 9 | ||
| Ниволумаб** + ипилимумаб** | Сунитиниб** | CheckMate 214 | Albiges, 2020 | ОВ, БПВ, ЧОО при плохом и промежуточном прогнозе IMDC | 1096 | 11,2 | 8,3 | 0,74 (0,62−0,88) | 48,1 | 26,6 | 0,65 (0,54–0,78) | 42 | 27 | ||
| Пембролизумаб** + #акситиниб** | Сунитиниб** | KEYNOTE-426 | Rini, 2021 | ОВ, БПВ | 861 | 15,7 | 11,1 | 0,68 (0,58 0,80) | 42-мес. 57,5 % | 42-мес 48,5% | 0,73 (0,60–0,88) | 60,4 | 39,6 | ||
| Авелумаб** + #акситиниб** | Сунитиниб** | JAVELIN Renal 101 | Motzer 2019 | БПВ, ОВ при PD-L1+ | 886 | 13,8 | 7,2 | 0,61 (0,47–0,79) | Незрелые данные | 55,2 | 25,5 | ||||
| Пембролизумаб** + ленватиниб** | Сунитиниб** | KEYNOTE-581/CLEAR | Motzer, 2021 | БПВ | 1069 | 23,9 | 9,2 | 0,39 (0,32–0,49) | 24-мес. 79,2% | 24-мес. 70,4% | 0,66 (0,49–0,88) | 71,0 | 36,1 | ||
| Ниволумаб** + кабозантиниб** | Сунитиниб** | CheckMate 9ER | Choueiri, 2021 | БПВ | 651 | 16,6 | 8,3 | 0,51 (0,41–0,64) | 12-мес. 85,7% | 12-мес. 75,6% | 0,60 (0,40–0,89) | 55,7 | 27,1 | ||
| 2-я линия | |||||||||||||||
| Эверолимус** | Плацебо | RECORD-1 | Motzer 2008, 2010 | БПВ | 410 | 4,9 | 1,9 | 0,33 (0,25–0,43) | 14,8 | 14,4 | 0,87 (0,65–1,17) | 1,8 | 0 | ||
| Сорафениб** | Плацебо | TARGET | Escudier 2007, 2009 | ОВ | 903 | 5,5 | 2,8 | 0,44 (0,35–0,55) | 17,8 | 15,2 | 0,88 (0,74–1,04) | 2 | 0 | ||
| Акситиниб** | Сорафениб** | AXIS | Rini 2011 | БПВ | 723 | 6,7 | 4,7 | 0,66 (0,55–0,81) | 20,1 | 19,2 | 0,97 (0,80–1,17) | 19 | 9 | ||
| Ленватиниб** + эверолимус** | Эверолимус** | 205 | Motzer 2015,2016 | БПВ | 153 | 14,6 | 5,5 | 0,40 (0,24–0,68) | 25,5 | 15,4 | 0,51 (0,3–0,88) | 35 | 0 | ||
| Кабозантиниб** | Эверолимус** | METEOR | Choueiri 2015, 2016 | БПВ | 658 | 7,4 | 3,9 | 0,51 (0,41–0,62) | 21,4 | 16,5 | 0,66 (0,53–0,83) | 17 | 3 | ||
| Ниволумаб** | Эверолимус** | CheckMate 025 | Motzer 2015 | ОВ | 821 | 4,6 | 4,4 | 0,88 (0,75−1,03) | 25,8 | 19,7 | 0,74 (0,63−0,88) | 21,5 | 3,9 | ||
o комбинации пембролизумаба** с #акситинибом** (пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед в комбинации с #акситинибом** 5 мг 2 раза в сутки перорально ежедневно) [187,249] или
Для пембролизумаба** 200 мг: Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Для пембролизумаба** 400 мг: Уровень убедительности рекомендаций − С (уровень достоверности доказательств –4).
o комбинации авелумаба** с #акситинибом** [189] (#авелумаб** в дозе 10 мг/кг или авелумаб** 800 мг в/в капельно в течение 1 ч 1 раз в 2 нед, #акситиниб** 5 мг 2 раза в сутки перорально) [189, 254] или
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o комбинации пембролизумаба** с ленватинибом** (пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед в комбинации с ленватинибом** 20 мг/сут перорально ежедневно) [190,250] или
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
o комбинации ниволумаба** с кабозантинибом** (#ниволумаб** в дозе 240 мг в/в капельно 1 раз в 2 нед или 480 мг 1 раз в 4 нед в комбинации с кабозантинибом** 40 мг в сутки перорально ежедневно) [191,251].
Для ниволумаба** 240 мг: Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Для ниволумаба** 480 мг: Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 4).
o монотерапии пазопанибом** (пазопаниб** 800 мг/сут перорально ежедневно) [181, 182, 207, 208] или
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
o монотерапии сунитинибом** (сунитиниб** 50 мг/сут перорально ежедневно в течение 4 нед с интервалом между циклами 2 нед) [180, 208].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
o комбинации ниволумаба** с ипилимумабом** (ниволумаб** 3 мг/кг или #ниволумаб 240 мг в/в капельно и ипилимумаб** 1 мг/кг в/в капельно 1 раз в 3 нед; Далее проводится монотерапия препаратом ниволумаб** в дозе 3 мг/кг или 240 мг – 1-е введение через 3 нед после последнего совместного введения, далее каждые 2 нед или в дозе 480 мг – 1-е введение через 6 нед после последнего совместного введения, далее каждые 4 нед [186, 209, 210, 255] или
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
o комбинации пембролизумаба** с #акситинибом** (пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед, #акситиниб** 5 мг 2 раза в сутки перорально ежедневно) [187, 209, 210, 249] или
Для пембролизумаба** 200 мг: Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Для пембролизумаба** 400 мг: Уровень убедительности рекомендаций − С (уровень достоверности доказательств –4).
o комбинации пембролизумаба** с ленватинибом** (пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед в комбинации с ленватинибом** 20 мг/сут перорально ежедневно) [190, 249] или
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
o комбинации ниволумаба** с кабозантинибом** (ниволумаб** в дозе 240 мг в/в капельно 1 раз в 2 нед или 480 мг 1 раз в 4 нед в комбинации с кабозантинибом** 40 мг/сут перорально ежедневно) [191, 251].
Для ниволумаба** 240 мг: Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Для ниволумаба** 480 мг: Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 4).
o комбинации авелумаба** с #акситинибом** (#авелумаб** в дозе 10 мг/кг или авелумаб** 800 мг в/в капельно в течение 1 ч 1 раз в 2 нед, #акситиниб** 5 мг 2 раза в сутки перорально) [189, 254] или
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o монотерапии кабозантинибом** (кабозантиниб** 60 мг/сут перорально ежедневно) [184, 209, 211].
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
В 1-й линии терапии ПКР с саркоматоидной дифференцировкой пациентам групп промежуточного и плохого прогноза IMDC рекомендуется предпочтительное назначение комбинации ниволумаба** с ипилимумабом** (ниволумаб** 3 мг/кг или #ниволумаб** 240 мг в/в капельно и ипилимумаб** 1 мг/кг в/в капельно 1 раз в 3 нед Далее проводится монотерапия препаратом ниволумаб** в дозе 3 мг/кг или 240 мг – 1-е введение через 3 нед после последнего совместного введения, далее каждые 2 нед или в дозе 480 мг – 1-е введение через 6 нед после последнего совместного введения, далее каждые 4 нед [186, 209, 210, 255].
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Для ниволумаба** 480 мг: Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 4).
o комбинации пембролизумаба** с #акситинибом** (пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед, #акситиниб** 5 мг 2 раза в сутки перорально ежедневно) [187, 249] или
Для пембролизумаба** 200 мг: Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Для пембролизумаба** 400 мг: Уровень убедительности рекомендаций − С (уровень достоверности доказательств –4).
o комбинации авелумаба** с #акситинибом** (#авелумаб** в дозе 10 мг/кг или авелумаб** 800 мг в/в капельно в течение 1 ч 1 раз в 2 нед, #акситиниб** 5 мг 2 раза в сутки перорально) [188, 254].
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o комбинации пембролизумаба** с ленватинибом** (пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед в комбинации с ленватинибом** 20 мг/сут перорально ежедневно) [190,250] или
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o монотерапии #пембролизумабом** (#пембролизумаб** в дозе 200 мг в/в капельно 1 раз в 3 нед или 400 мг 1 раз в 6 нед) [200, 249] или
Уровень убедительности рекомендаций − C (уровень достоверности доказательств – 4).
o комбинации ниволумаба** с ипилимумабом** (ниволумаб** 3 мг/кг или #ниволумаб** 240 мг в/в капельно и ипилимумаб** 1 мг/кг в/в капельно 1 раз в 3 нед. Далее проводится монотерапия препаратом ниволумаб** в дозе 3 мг/кг или 240 мг – 1-е введение через 3 нед после последнего совместного введения, далее каждые 2 нед или в дозе 480 мг – 1-е введение через 6 нед после последнего совместного введения, далее каждые 4 нед [186, 201, 209, 210, 256] или
Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 4).
o монотерапии сунитинибом** (сунитиниб** 50 мг/сут перорально ежедневно в течение 4 нед с интервалом между циклами 2 нед) [203,252] или
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
o монотерапии #эверолимусом** (#эверолимус** 10 мг/сут перорально) [204, 205, 212].
Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 4).
o монотерапии ниволумабом** (ниволумаб** 3 мг/кг или 240 мг в/в капельно 1 раз в 2 нед или 480 мг в/в капельно 1 раз в 4 нед) [198, 211, 212] или
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o монотерапии кабозантинибом** (кабозантиниб** 60 мг/сут перорально ежедневно) [184, 211, 212].
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
o монотерапии кабозантинибом** (кабозантиниб** 60 мг/сут перорально ежедневно) [184, 211] или
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
o комбинации ленватиниба** с эверолимусом** (ленватиниб** 18 мг/сут перорально ежедневно, #эверолимус** 5 мг/сут перорально ежедневно) [197, 211].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
o монотерапии #кабозантинибом** (#кабозантиниб** 60 мг/сут перорально ежедневно) [196, 211] или
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
o комбинации ленватиниба** с эверолимусом** (ленватиниб** 18 мг/сут перорально ежедневно, #эверолимус** 5 мг/сут перорально ежедневно) [213] или
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
o монотерапии #сунитинибом** (#сунитиниб** 50 мг/сут перорально ежедневно в течение 4 нед с интервалом между циклами 2 нед) [202, 214] или
Уровень убедительности рекомендаций − B (уровень достоверности доказательств – 3).
o монотерапии пазопанибом** (пазопаниб** 800 мг/сут перорально ежедневно) [214, 215].
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o монотерапии акситинибом** (акситиниб** 5 мг 2 раза в сутки перорально с эскалацией дозы до 10 мг 2 раза в сутки) [195] или
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
o монотерапии пазопанибом** (пазопаниб** 800 мг/сут перорально ежедневно) [181, 215–219].
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 1).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 3).
o монотерапии #эверолимусом** (#эверолимус** 10 мг/сут перорально ежедневно) [214] или
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
o монотерапии #сунитинибом** (#сунитиниб** 50 мг/сут перорально ежедневно в течение 4 нед с интервалом между циклами 2 нед) [214] или
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
o монотерапии пазопанибом** (пазопаниб** 800 мг/сут перорально ежедневно) [216, 217] или
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
o монотерапии #сорафенибом** (#сорафениб** 800 мг/сут перорально ежедневно) [192, 218] или
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
o комбинации #бевацизумаба** с ИФН-α** (#бевацизумаб** 10 мг/кг в/в капельно 1 раз в 2 нед, ИФН-α** 3 млн ЕД п/к 3 раза в нед с эскалацией дозы до 9 млн ЕД) [178, 179, 220, 253].
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций − C (уровень достоверности доказательств – 2).
Комментарий: алгоритм выбора режима лекарственной терапии у пациентов с ПКР представлен в табл. П4 Приложения Б.
Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 5).
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов, страдающих раком паренхимы почки, с хроническим болевым синдромом, соответствуют принципам обезболивания, изложенным в действующих клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
Принципы профилактики и лечения анемии у пациентов с раком паренхимы почки соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях», размещенным в рубрикаторе клинических рекомендаций Минздрава России https://cr.minzdrav.gov.ru
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (Коллектив авторов: Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. DOI: 10.18027/2224–5057–2018–8–3s2–502–511; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-35.pdf).
Принципы лечения и профилактики костных осложнений у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (Коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., Семиглазова Т.Ю. DOI: 10.18027/2224-5057-2018-8-3s2-512-520; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (Коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М. DOI: 10.18027/2224-5057-2018-8-3s2-521-530; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (Коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. DOI: 10.18027/2224-5057-2018-8-3s2-531-544; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-38.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (Коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А. DOI: 10.18027/2224-5057-2018-8-3s2-545-563; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-39.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (Коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В. DOI: 10.18027/2224-5057-2018-8-3s2-564-574; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf).
Принципы нутритивной поддержки у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (Коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10.18027/2224-5057-2018-8-3s2-575-583; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (Коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. DOI: 10.18027/2224-5057-2018-8-3s2-591-603; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-44.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (Коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10.18027/2224-5057-2018-8-3s2-604-609; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-45.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (Автор: Буйденок Ю.В. DOI: 10.18027/2224-5057-2018-8-3s2-610-616; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf).
Принципы профилактики и лечения иммуноопосредованных НЯ у пациентов с раком паренхимы почки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» (Коллектив авторов: Проценко С.А., Антимоник Н.Ю., Берштейн Л.М., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Чубенко В.А., Юдин Д.И., DOI: 10.18027/2224-5057-2018-8-3s2-636-665; https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-48.pdf).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: роль потребления кофе в этиологии ПКР достаточно неизучена. Результаты изучения роли питания в этиологии ПКР также не очень убедительны. Некоторые из них (но не все) показали, что питание, богатое животными жирами, белками, в частности молоком, и бедное овощами и фруктами повышает риск ПКР.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 3).
Комментарий: психологическая поддержка в плане предреабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической предреабилитации, лучше адаптируются к повседневной жизни после хирургического лечения.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций − А (уровень достоверности доказательств – 3).
Комментарий: тактика fast track rehabilitation и ERAS, включающая комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизация и вертикализация) пациентов, уже с 1–2-х суток после операции не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций. Тактика fast track rehabilitation уменьшает длительность пребывания в стационаре и частоту послеоперационных осложнений. Тактика fast track эффективна и безопасна у пациентов урологического профиля.
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 2).
Комментарий: комплексный fast-track-подход к реабилитации пациентов после лапароскопической нефрэктомии позволяет сократить длительность пребывания пациента в отделении интенсивной терапии, продолжительность госпитализации. Кроме того, данная стратегия позволяет лучше контролировать болевой синдром и удовлетворенность пациента хирургическим лечением.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств – 4).
Комментарий: проведение 20-минутных сеансов массажа, начиная со 2-х суток после операции, уменьшает интенсивность болевого синдрома, беспокойство, напряжение, улучшая качество жизни.
Уровень убедительности рекомендаций − A (уровень достоверности доказательств − 1).
Комментарий: аэробные нагрузки следует проводить длительностью 150 мин в неделю и силовые – 2 раза в неделю.
Уровень убедительности рекомендаций − С (уровень достоверности доказательств − 4).
Уровень убедительности рекомендаций − В (уровень достоверности доказательств − 1).
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Эффективной профилактики ПКР не существует.
Диспансерное наблюдение организуется в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете медицинской организации, онкологическом диспансере (онкологической больнице) или иных медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями.
Комментарии: в соответствии с приказом Министерства здравоохранения Российской Федерации от 04 июня 2020 г. № 548н «Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями» для пациентов с ПКР устанавливается группа диспансерного наблюдения (2-ДН-онко). Категория наблюдаемых пациентов – лица с подтвержденным диагнозом ЗНО. Рекомендуемая периодичность диспансерных приемов пациента врачом (в течение первого года-1 раз в 3 месяца, в течение второго года-1 раз в 6 месяцев, в дальейшем-1 раз в год (если течение заболевания не требует изменения тактики ведения больного).
Наблюдение за пациентами с ПКР, подвергнутыми хирургическому лечению, проводится с целью выявления рецидивов заболевания (местный рецидив, отдаленные метастазы) и осложнений проведенного лечения (включая поздние хирургические осложнения и прогрессирование хронической болезни почек). Для достижения поставленной цели необходимо регулярное проведение комплексного обследования, включающего визуализацию области операции и зон типичного метастазирования ПКР, а также оценку почечной функции (биохимический анализ крови). Доказано, что проведение регулярного обследования пациентов ассоциировано с увеличением ОВ, однако использование методов радиологической диагностики связано с лучевой нагрузкой на организм пациента. Введение рентгеноконтрастного вещества больным со скоростью клубочковой фильтрации <20 мл/мин/1,73 м2 может привести к острой почечной недостаточности. Для соблюдения баланса между риском и пользой алгоритм наблюдения должен зависеть от вероятности развития рецидива [240].
От 20 до 30 % пациентов после радикального хирургического лечения имеют прогрессирование ПКР. Наиболее частой локализацией рецидивов являются легкие (50−60 % пациентов). Чаще всего рецидивы развиваются в течение 1−2 лет, доминирующая доля всех случаев прогрессирования регистрируется в первые 3 года после операции [241]. Риск прогрессирования ПКР у радикально оперированных пациентов прямо коррелирует со стадией опухолевого процесса TNM, наличием нПКР, степенью анаплазии опухоли (для местных рецидивов и метастазов) и использованием органосохраняющего лечения (для местных рецидивов). Риск местного рецидива ПКР наиболее высок при использовании аблативного лечения, несколько ниже – после РП (коррелирует с размерами удаленной опухоли) и является минимальным после РН [242].
– сбор жалоб и анамнеза, физикальное обследование через 3, 6 и 12 мес после аблации, далее – ежегодно;
– выполнение общего и биохимического анализов крови через 3, 6 и 12 мес после аблации, далее – ежегодно;
– КТ или МРТ органов брюшной полости и забрюшинного пространства с в/в контрастированием (при отсутствии противопоказаний) через 3, 6 и 12 мес после аблации, далее – ежегодно;
– рентгенография или КТ грудной полости ежегодно.
Наблюдение проводится в течение 5 лет, при наличии показаний – более длительное время. При подозрении на рецидив обследование может проводиться чаще и включать биопсию опухоли [240, 243, 244].
Уровень убедительности рекомендаций ‒ C (уровень достоверности доказательств – 4).
– сбор жалоб и анамнеза, физикальное обследование через 3, 6 и 12 мес после РП или РН, далее – ежегодно;
– выполнение общего и биохимического анализов крови через 3, 6 и 12 мес после РП или РН, далее – ежегодно;
– предпочтительно выполнение КТ или МРТ органов брюшной полости и забрюшинного пространства с в/в контрастированием (при отсутствии противопоказаний) или − менее желательно − УЗИ органов брюшной полости и забрюшинного пространства через 3, 6 и 12 мес после РП или РН, далее – ежегодно;
– рентгенография или КТ грудной полости ежегодно.
При саркоматоидном компоненте в первичной опухоли, степени анаплазии ПКР G3–G4 или выявлении опухолевых клеток по краю резекции частота исследований должна быть выше (каждые 3 мес в течение 1 года, каждые 6 мес в течение 2-го и 3-го года наблюдения, далее – ежегодно). Наблюдение проводится в течение 5 лет, при саркоматоидном компоненте в первичной опухоли, степени анаплазии ПКР G3–G4 или выявлении опухолевых клеток по краю резекции – более длительное время [240, 243, 244].
Уровень убедительности рекомендаций ‒ C (уровень достоверности доказательств – 4).
Наблюдение проводится в течение 5 лет и может быть пролонгировано по решению лечащего врача [240, 243, 244].
Уровень убедительности рекомендаций ‒ А (уровень достоверности доказательств – 2).
Цели наблюдения за пациентами с рецидивом ПКР или неоперабельной опухолью, получающими системную противоопухолевую терапию, заключаются в оценке эффекта лечения, выявлении прогрессирования, своевременной диагностике НЯ, развившихся во время терапии.
– опрос и физикальный осмотр каждые 4 нед в течение 1 цикла лечения, далее при отсутствии отклонений, требующих пристального контроля, – по решению лечащего врача, после каждых 3–6 циклов лечения;
– выполнение рутинных лабораторных тестов, включающих общий клинический анализ крови, биохимический общетерапевтический анализ крови, общий анализ мочи до начала и в процессе лечения. Частота выполнения лабораторных тестов определяется индивидуальными требованиями, предъявляемыми к пациентам, получающим конкретные режимы терапии;
– определение уровня тиреотропного гормона в крови до начала терапии TKI и ингибиторами PD-1, далее при отсутствии лабораторных и клинических отклонений, требующих более пристального контроля, – после каждых 3–6 циклов лечения;
– радиологическое исследование органов грудной, брюшной полостей, забрюшинного пространства и таза до начала и в процессе лекарственной терапии. Методы выбора для визуализации данных областей – КТ или МРТ с контрастированием. Частота контрольных исследований – каждые 6–16 нед – определяется лечащим врачом индивидуально;
– МРТ головного мозга с контрастированием пациентам с впервые возникшими в процессе терапии неврологическими симптомами и пациентам с метастазами в головной мозг, получающими лечение. Частота контрольных исследований – каждые 6–16 нед – определяется лечащим врачом индивидуально;
– сцинтиграфия костей всего тела (остеосцинтиграфию) пациентам с впервые возникшими в процессе терапии симптомами костного поражения и пациентам с метастазами в кости, получающими лечение. Частота контрольных исследований – каждые 6–16 нед, определяется лечащим врачом индивидуально;
– рентгенография, КТ или МРТ костей при сомнительных результатах сцинтиграфии костей скелета или наличии клинических показаний к коррекции костных осложнений для планирования лучевой терапии или хирургического вмешательства;
– ЭхоКГ пациентам группы высокого риска кардиоваскулярных осложнений антиангиогенной терапии до начала лечения и каждые 12–24 нед в процессе лечения или при развитии/прогрессировании клинических симптомов сердечной недостаточности [240, 243, 244].
Уровень убедительности рекомендаций ‒ C (уровень достоверности доказательств – 4).
После постановки диагноза наследственного онкологического синдрома и удаления первичной опухоли(ей) возникает необходимость дальнейшего динамического наблюдения носителя герминальной патогенной (вероятно патогенной) мутации, чтобы вовремя обнаружить новый ПКР и/или опухоли в других органах-мишенях. Также динамическое наблюдение показано родственникам пациента, если в ходе медико-генетического консультирования и молекулярно-генетической диагностики у них была выявлена мутация, идентичная таковой у пациента.
o с 1 года офтальмоскопию (для выявления ангиом/гемангиобластом сетчатки);
o с 5 лет мониторинг артериального давления и анализ метанефринов по плазме крови/моче (для выявления феохромоцитомы);
o с 12 лет МРТ головного и спинного мозга (для выявления гемангиобластом центральной нервной системы), органов брюшной полости (для выявления опухолей и кист почек, надпочечников и поджелудочной железы);
o с 14 лет аудиограмму (для выявления опухолей эндолимфатического протока внутреннего уха).
Диагностика новообразований почки при более редких наследственных онкологических синдромах проводится при динамическом наблюдении со следующей периодичностью:
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи, а при отсутствии в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 3 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет) биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней со дня назначения исследований.
Диагноз онкологического заболевания устанавливается врачом-специалистом на основе результатов диагностических исследований, включающих в том числе проведение цитологической и (или) гистологической верификации диагноза, за исключением случаев, когда взятие биопсийного и (или) пункционного материала не представляется возможным.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения. В случае подтверждения у пациента наличия онкологического заболевания информация об уточненном диагнозе направляется из онкологического диспансера или организации субъекта Российской Федерации, исполняющей функции регистрации пациентов с впервые выявленном злокачественным новообразованием, в медицинскую организацию, осуществляющую диспансерное наблюдение пациента
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи. (Пункт 5: для получения специализированной медицинской помощи в плановой форме выбор федеральной медицинской организации осуществляется по направлению лечащего врача.) В случае если в реализации Программы принимают участие несколько федеральных медицинских организаций, оказывающих специализированную медицинскую помощь при заболеваниях, состояниях (группе заболеваний, состояний), соответствующих заболеваниям, состояниям (группе заболеваний, состояний) пациента, лечащий врач обязан проинформировать пациента (законного представителя пациента) о возможности выбора федеральной медицинской организации, в том числе о возможных сроках ожидания специализированной медицинской помощи, которые могут превышать сроки ожидания, установленные программой государственных гарантий бесплатного оказания гражданам медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения онкологического заболевания (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.), требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, а также проведение эндоскопических исследований при невозможности выполнить их амбулаторно, требуют последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Известные прогностические факторы при местно-распространенном неоперабельном и мПКР, которые рекомендуется регистрировать (факторы прогноза IMDC) [15]:
На основании наличия и количества имеющихся факторов риска выделены группы прогноза:
Критерии оценки качества специализированной медицинской помощи взрослым пациентам при раке паренхимы почки указаны в табл. 4.
Таблица 4. Критерии оценки качества медицинской помощи
| № | Критерии качества | Выполнение |
|---|---|---|
| 1 | Выполнено УЗИ органов забрюшинного пространства и органов брюшной полости | да/нет |
| 2 | Выполнена 3-фазная спиральная КТ органов брюшной полости и забрюшинного пространства с в/в болюсным контрастированием | да/нет |
| 3 | Выполнена ЭхоКГ пациенту с опухолевым венозным тромбозом, распространяющимся выше нижней границы печени | да/нет |
| 4 | Выполнена КТ органов грудной полости | да/нет |
| 5 | Выполнены сцинтиграфия почек (динамическая нефросцинтиграфия) у пациента, имеющего нарушение почечной функции и/или единственную функционирующую почку, или билатеральное опухолевое поражение почек, и/или риск нарушения почечной функции вследствие сопутствующих заболеваний или состояний | да/нет |
| 6 | Выполнена сцинтиграфия костей всего тела (остеосцинтиграфия) у пациента с костными болями и/или переломами костей, и/или повышением уровня щелочной фосфатазы сыворотки крови, и/или при наличии местно-распространенной или метастатической стадии заболевания | да/нет |
| 7 | Выполнено радикальное хирургическое вмешательство пациенту с операбельным локализованным или местно-распространенным раком почки, способному перенести операцию | да/нет |
| 8 | Выполнена цНЭ пациенту с метастатическим раком почки группы хорошего прогноза IMDC или группы промежуточного прогноза MSKCC с ответом на индукционную таргетную терапию TKI или любой прогностической группы при наличии/высоком риске развития жизнеугрожающих симптомов/осложнений первичной опухоли или любой прогностической группы при наличии потенциально удалимых солитарных или единичных метастазов. | да/нет |
| 9 | Выполнено радикальное удаление солитарных или единичных или паллиативное удаление симптомных метастазов пациенту с метастатическим раком паренхимы почки, способному перенести операцию | да/нет |
| 10 | Выполнено патологоанатомическое исследование операционного материала с указанием параметров в соответствии с рекомендациями (у пациентов, получивших хирургическое лечение) | да/нет |
| 11 | Проведена лекарственная терапия (таргетная терапия и/или иммунотерапия) пациенту с метастатическим или местно-распространенным неоперабельным ПКР | да/нет |
| 12 | Проведена оценка эффективности проводимой лекарственной терапии каждые 2−3 мес от начала лечения | да/нет |
| 13 | Выполнены общий клинический и общетерапевтический биохимический анализы крови, определение уровня альбумина в крови и определение уровня общего кальция в крови, ионизированного кальция в крови до начала лекарственной терапии у пациента с метастатическим или местно-распространенным неоперабельным ПКР | да/нет |
Блок по организации медицинской помощи:
Конфликт интересов
Все члены рабочей группы подтвердили отсутствие конфликта интересов/финансовой поддержки, о которых необходимо сообщить.
Целевая аудитория данных клинических рекомендаций:
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методы, использованные для сбора/селекции доказательств:
• поиск в электронных базах данных;
• анализ современных научных разработок по проблеме герминогенных опухолей в России и за рубежом;
• обобщение практического опыта российских и зарубежных специалистов.
Для оценки уровней убедительности рекомендаций (УУР) и уровней достоверности доказательств (УДД) по каждому тезису-рекомендации выполнен отдельный систематический обзор доказательств эффективности и/или безопасности медицинского вмешательства, включающий следующие этапы:
1. Определение критериев поиска и отбора публикаций о клинических исследованиях (КИ) эффективности и/или безопасности медицинского вмешательства, описанного в тезисе-рекомендации.
2. Систематический поиск и отбор публикаций о КИ в соответствии с определенными ранее критериями.
3. Определение УДД и УУР на основании результатов систематического поиска и отбора публикаций о КИ.
Оценка УДД и УУР проводится на основании единых шкал, представленных в табл. П1–3.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай−контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
|---|---|
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Индикаторы доброкачественной клинической практики (Good Practice Points – GPPs): доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Экономический анализ: анализ стоимости не проводился, публикации по фармакоэкономике не анализировались.
Методы валидизации рекомендаций:
● внешняя экспертная оценка;
● внутренняя экспертная оценка.
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов и урологов первичного звена в отношении доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать прежде всего доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с раком почки. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается, для того чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1) клинические рекомендации Европейской ассоциации урологов;
2) приказ Министерства здравоохранения РФ от 19 февраля 2021 г. N 116н “Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях” С изменениями и дополнениями от 24 января 2022 г.;
3) приказ Минздрава России от 04.06.2020 № 548н «Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями»;
4) приказ Минздрава России от 21.03.2022 № 182н «Об утверждении стандартов медицинской помощи взрослым при раке паренхимы почки».
5) распоряжение Правительства Российской Федерации от 12.10.2019 г. № 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи»;
6) приказ Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588).
7) методические рекомендации по проведению оценки научной обоснованности, включаемой в клинические рекомендации информации, ФГБУ «Центр экспертизы и контроля качества» Министерства здравоохранения Российской Федерации, 2019 г.
8) Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru и на сайте RUSSCO.
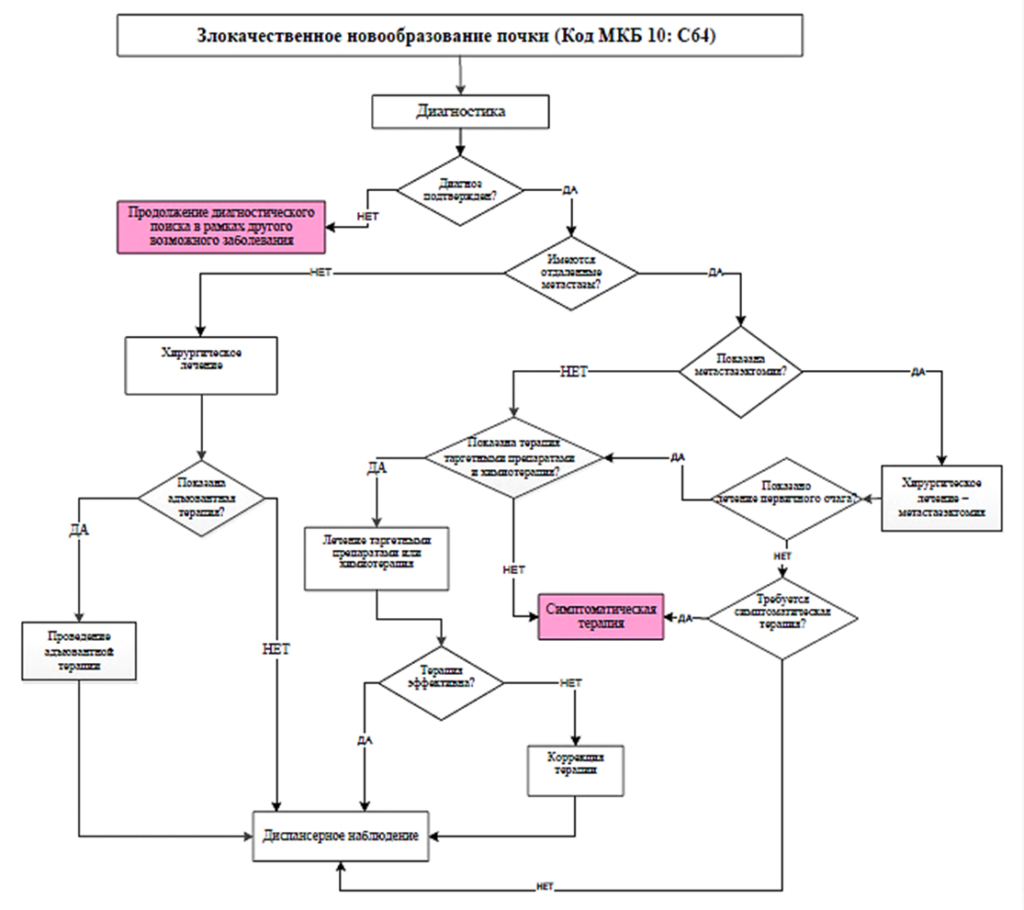
Таблица П4. Алгоритм выбора режима лекарственной терапии у пациентов со сПКР
| Предшествующее лечение | Группа прогноза IMDC | Режимы предпочтения/уровень рекомендаций | Альтернативные режимы/уровень рекомендаций | Допустимые режимы/уровень рекомендаций |
|---|---|---|---|---|
| 1-я линия терапии сПКР | ||||
| Не было | Хороший | Пембролизумаб** с #акситинибом**/ААвелумаб** с #акситинибом**/АПембролизумаб** с ленватинибом**/АНиволумаб** с кабозантинибом**/А | Пазопаниб**/АСунитиниб**/А | – |
| Промежуточный и плохой | Ниволумаб** с ипилимумабом**/АПембролизумаб** с #акситинибом**/АПембролизумаб** с ленватинибом**/АНиволумаб** с кабозантинибом**/А | Авелумаб** с #акситинибом**/АКабозантиниб**/В | – | |
| 1-я линия терапии ПКР с саркоматоидной дифференцировкой | ||||
| Не было | Промежуточный и плохой | Ниволумаб** с ипилимумабом**/АНиволумаб** с кабозантинибом**/А | Пембролизумаб** с #акситинибом**/ААвелумаб** с #акситинибом**/АПембролизумаб** с ленватинибом**/А | – |
| Все | Ниволумаб** с кабозантинибом**/А | Пембролизумаб** с #акситинибом**/ААвелумаб** с #акситинибом**/АПембролизумаб** с ленватинибом**/А | – | |
| 1-я линия терапии папиллярного ПКР | ||||
| Не было | Все | Кабозантиниб**/А | #Пембролизумаб**/Вниволумаб** с Ипилимумабом**/ВСунитиниб**/СЭверолимус**/С | – |
| 2-я линия терапии | ||||
| Анти-VEGF | Все | Ниволумаб**/АКабозантиниб**/А | Ленватиниб** с эверолимусом**/А | Акситиниб**/А |
| Анти-PD(L)-1 + анти-VEGF | Все | Клинические исследования | Кабозантиниб**/СЛенватиниб** с эверолимусом**/С | – |
| Анти-PD(L)-1 + анти-CTLA-4 | Все | Клинические исследования | Клинические исследования | Кабозантиниб**/СЛенватиниб** с эверолимусом**/AСунитиниб**/СПазопаниб**/С |
| Иммунотерапия цитокинами | Все | Акситиниб**/АПазопаниб**/А | Сунитиниб**/С | – |
| 3-я и последующие линии | ||||
| Любое | Все | – | – | Эверолимус**/ВСунитиниб**/ВПазопаниб**/ВБевацизумаб** с ИФН-α**/ССорафениб**/С |
| Плохой | – | – | Темсиролимус/С |
Пациента информируют о клинической картине и методах диагностики/стадирования ПКР, знакомят с различными методами лечения и их потенциальными результатами/осложнениями. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациент имел возможность задать все интересующие его вопросы.
Необходимо убедить пациента не стыдиться болезни и ознакомиться с научно-популярной литературой о ПКР.
Следует информировать пациента о характере последующего наблюдения после лечения ПКР, о важности регулярного обследования.
Пациентов с мПКР следует информировать о проводимых в Российской Федерации клинических исследованиях у пациентов с указанной стадией заболевания.
Самостоятельный контроль за течением заболевания со стороны пациента невозможен; приступы, требующие самостоятельной помощи, при раке почки отсутствуют; частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Преимущества отказа от табакокурения и потребления алкоголя
● Более высокие показатели выживаемости
● Бόльшая эффективность лечения
● Меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса)
● Ускоренное восстановление общего состояния после лечения
● Ниже риск рецидива
● Меньший риск вторых опухолей
● Меньший риск инфекций
● Выше качество жизни
Рекомендации при осложнениях химиотерапии/лучевой терапии – связаться с химиотерапевтом/лучевым терапевтом!
1) При повышении температуры тела 38 °C и выше:
● Рекомендовано применение противомикробной терапии по рекомендации химиотерапевта.
2) При стоматите:
● Диета – механическое, термическое щажение;
● Частое полоскание полости рта (каждый час) – ромашка, кора дуба, шалфей; смазывать слизистую полости рта облепиховым (персиковым) маслом;
● Обрабатывать полость рта по рекомендации врача-химиотерапевта.
3) При диарее:
● Диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
● Принимать препараты по рекомендации врача-онколога.
4) При тошноте:
● Принимать препараты по рекомендации врача-онколога.
| Параметр | RENAL | PADUA |
|---|---|---|
| Максимальный диаметр опухоли | 1 балл: ≤4 см | 1 балл: ≤4 см |
| 2 балла: >4…<7 см | 2 балла: 4–7 см | |
| 3 балла: ≥7 см | 3 балла: >7 см | |
| Эндофитный/экзофитный рост | 1 балл: ≥50 % | 1 балл: ≥50 % |
| 2 балла: <50 % | 2 балла: <50 % | |
| 3 балла: эндофитный | 3 балла: эндофитный | |
| Собирательная система | Или почечный синус | 1 балл: не вовлечена |
| 1 балл: на расстоянии >7 мм | 2 балла: смещена/инфильтрирована | |
| 2 балла: на расстоянии 4–7 мм | ||
| 3 балла: на расстоянии ≤4 мм | ||
| Полюсное расположение | 1 балл: полностью над или подполюсной линиейa | 1 балл: верхний/нижнийb |
| 2 балла: пересекает полюснуюлинию | 2 балла: средний | |
| 3 балла: >50 % пересекаетполюсную линию или пересекает осевую почечную срединную линию или полностью между полюсными линиями | ||
| Почечный край | – | 1 балл: латеральный |
| 2 балла: медиальный | ||
| Почечный синус | Включено в собирательную систему | 1 балл: не вовлечен |
| 2 балла: вовлечен | ||
| Передний/задний | Нет баллов | Нет баллов |
aПолюсные линии определяются как плоскость почки, над или под которой медиальная губа паренхимы прерывается жиром почечного синуса, сосудами или собирательной системой при аксиальной визуализации.
bПолюсные линии определяются по почечному синусу.
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status.
Оригинальная публикация: Oken M.M., Creech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., Carbone P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5(6):649−55 [245].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
| Балл | Описание |
|---|---|
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу(70–80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно –в вертикальном положении (50–60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 % по шкале Карновского) |
| 5 | Смерть |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Шкала Карновского.
Оригинальное название (если есть): Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C. (ed.). Evaluation of chemotherapeutic agents. New York: Columbia University Press, 1949. Pp.191–205 [246].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание (шаблон):
| Балл | Шкала Карновского |
|---|---|
| 100 | Состояние нормальное, жалоб нет |
| 90 | Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 | Нормальная активность с усилием, незначительные симптомы или признаки заболевания |
| 70 | Обсуживает себя самостоятельно, неспособен к нормальной деятельности или активной работе |
| 60 | Нуждается периодически в помощи, но способен сам удовлетворять бóльшую часть своих потребностей |
| 50 | Нуждается в значительной помощи и медицинском обслуживании |
| 40 | Инвалид, нуждается в специальной помощи, в том числе медицинской |
| 30 | Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 | Тяжелый больной. Необходимы госпитализация и активное лечение |
| 10 | Умирающий |
| 0 | Смерть |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Визуально-аналоговая шкала оценки болевого синдрома.
Оригинальное название: Visual Analog Scale for Pain (VAS Pain).
Источник (официальный сайт разработчиков, публикация с валидацией): Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken) 2011;63(Suppl 11):S240–52 [247].
Тип: шкала оценки.
Назначение: предназначена для количественной оценки болевого синдрома с учетом субъективных ощущений больного и подбора анальгезирующей терапии.
Содержание (шаблон):
«Оцените по шкале выраженность боли, где 0 – отсутствие боли, а 10 – нестерпимая боль максимальной выраженности».
Инструкция: больному на 10-сантиметровой линии предлагается отметить степень выраженности боли по шкале от 0 до 10.
Ключ: 1–3 балла – слабая боль; 4–7 баллов – умеренная боль; 8 и более баллов – сильная боль.
Название на русском языке: Критерии оценки ответа солидных опухолей на лечение 1.1.
Оригинальное название (если есть): Response Evaluation Criteria In Solid Tumors 1.1 (RECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M., Rubinstein L., Shankar L., Dodd L., Kaplan R., Lacombe D., Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009;45(2):228–47. DOI: 10.1016/j.ejca.2008.10.026 [248].
Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на лечение.
Содержание (шаблон):
| Ответ на лечение | RECIST 1.1 |
|---|---|
| Полный ответ | Отсутствие всех целевых образований или лимфоузлов ≥10 мм по короткой оси |
| Частичный ответ | Уменьшение сумм наибольших диаметров целевых очагов на ≥30 % |
| Прогрессирование | Увеличение сумм наибольших диаметров целевых очагов на ≥20 % с абсолютным приростом ≥5 ммПоявление новых очагов |
| Стабилизация | Ничего из перечисленного |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Критерии оценки иммуноопосредованного ответа солидных опухолей.
Оригинальное название (если есть): Immune-Related Response Evaluation Criteria In Solid Tumors (iRECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Seymour L., Bogaerts J., Perrone A. et al. RECIST working group. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol 2017;18(3):e143–52.
DOI: 10.1016/S1470-2045(17)30074-8. Epub 2017 Mar 2 [221].
Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на иммунотерапию.
Содержание (шаблон):
| Ответ на лечение | iRECIST |
|---|---|
| Полный ответ | Отсутствие всех целевых образований или лимфоузлов ≥10 мм по короткой оси |
| Частичный ответ | Уменьшение сумм наибольших диаметров целевых очагов на ≥30 % |
| Прогрессирование | Увеличение сумм наибольших диаметров целевых очагов на ≥20 % с абсолютным приростом ≥5 ммПоявление новых очагов не является признаком прогрессирования; диаметры новых очагов прибавляются к общей сумме таргетных очагов; окончательная оценка ответа опухоли требует подтверждения через 4 нед |
| Стабилизация | Ничего из перечисленного |
Ключ (интерпретация): приведен в самой шкале.