ᅠ ᅠ
Скачать в PDF ⟶
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:
C67
Возрастная категория:
Взрослые
Год утверждения:
2023
Пересмотр не позднее:⠀
2025
Статус
Действует
Рабочая группа:
Блок по организации медицинской помощи:
Конфликта интересов нет.
Разработчик клинической рекомендации:
БЦЖ – бацилла Кальметта–Герена
в/в – внутривенно
ВМП – верхние мочевыводящие пути
ВОЗ – Всемирная организация здравоохранения
ИМП – инфекция мочевых путей
КТ – компьютерная томография
ЛТ – лучевая терапия
ЛУ – лимфатический узел
ЛФК – лечебная физическая культура
МИ РМП – мышечно-инвазивный рак мочевого пузыря
МКА – моноклональные антитела (код АТХ-классификации: L01XС)
МКБ-10 – международная классификация болезней 10-го пересмотра
МП – мочевой пузырь
МРТ – магнитно-резонансная томография
НМИ РМП – немышечно-инвазивный рак мочевого пузыря
ПСА – простат-специфический антиген
ПХТ – полихимиотерапия
РМП – рак мочевого пузыря
РКИ – рандомизированное контролируемое исследование
США – Соединенные Штаты Америки
ТУР – трансуретральная резекция мочевого пузыря
УД – уровень доказательности
УЗИ – ультразвуковое исследование
ФД – флюоресцентная диагностика
ХТ – химиотерапия
ЦИ – цитологическое исследование
ЦЭ – цистэктомия
AUC – area under curve – площадь под фармакологической кривой; расчет дозы карбоплатина по площади под фармакологической кривой производится по формуле Calvert (1989): доза карбоплатина = AUC × (клиренс креатинина + 25)
BTA – bladder tumor antigen (антиген рака мочевого пузыря)
CIS – карцинома in situ
PUNLMP – papillary urothelial neoplasm of low malignant (папиллярная неоплазия уротелия с низким злокачественным потенциалом)
RECIST – response evaluation criteria in solid tumours (критерии ответа солидных опухолей на терапию)
UBC – urinary bladder cancer (рак мочевого пузыря)
рчГ-КСФ – рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор (группа колониестимулирующих факторов согласно анатомо-терапевтическо-химической классификации)
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (off-label, офф-лейбл)
Адъювантная химиотерапия – вид химиотерапии, проводимый после полного удаления первичной опухоли для устранения возможных метастазов.
БЦЖ-терапия – иммунотерапия неактивными бактериями туберкулеза, которую проводят в послеоперационном периоде с целью снизить возможность развития рецидива рака мочевого пузыря с использованием вакцины для иммунотерапии рака мочевого пузыря**.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Неоадъювантная химиотерапия – вид химиотерапии, проводимый непосредственно перед хирургическим удалением первичной опухоли для улучшения результатов операции или лучевой терапии и для предотвращения образования метастазов.
Операция типа Брикера – операция по отведению мочи в выделенный участок подвздошной кишки – создание уростомы или илеального кондуита.
Ортотопическая пластика мочевого пузыря – операция по отведению мочи через мочеиспускательный канал, которая включает использование различных вариантов гастроинтестинальных резервуаров, соединённых с мочеиспускательным каналом; ортотопическое отведение мочи (неоцистис, ортотопическая замена мочевого пузыря).
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Предреабилитация (prehabilitation) – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Трехстаканная проба мочи – это анализ трех порций мочи, полученных при однократном мочеиспускании, который позволяет установить локализацию патологического процесса, вызвавшего повышение количества лейкоцитов и/или эритроцитов в моче.
Трансуретральная резекция мочевого пузыря – это эндоскопическая операция, которая выполняется с целью удаления новообразования/инородного тела мочевого пузыря с последующим микроскопическим исследованием полученной ткани.
Уретерокутанеостомия – хирургическая операция по созданию наружного свища мочеточника путем выведения дистального отдела мочеточника в рану и подшивания его слизистой оболочки к коже.
Уретроцистоскопия – это эндоскопическое вмешательство, которое применяется для визуальной оценки состояния просвета мочеиспускательного канала и мочевого пузыря, уточнения наличия в нем патологических образований, а также одновременного проведения эндоскопических вмешательств.
Уровни достоверности доказательств – отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам, достоверность доказательств определяется по трем основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций – в отличие от уровней достоверности доказательств, отражают не только степень уверенности в достоверности эффекта вмешательства, но и степень уверенности в том, что следование рекомендациям принесет в конкретной ситуации больше пользы, чем негативных последствий.
Флюоресцентное исследование – цистоскопия (введение в мочевой пузырь тонкой металлической трубочки с видеокамерой и освещением), которая выполняется с использованием фиолетового света после внутрипузырного введения специального препарата, который проникает в опухолевые клетки и светится ярким цветом.
Рак мочевого пузыря (РМП) – тяжелое, в ряде случаев инвалидизирующее заболевание, для которого не разработаны системы активного выявления, требующее тщательной дифференциальной диагностики, имеющее большую склонность к рецидивированию и прогрессированию.
РМП – полиэтиологическое заболевание. Значительное число его случаев связано с влиянием канцерогенных веществ, выделяемых с мочой, на уротелий.
Курение
Курение табака является наиболее значимым фактором риска для РМП. Табачный дым содержит ароматические амины и полициклические ароматические углеводороды, которые выводятся почками. Вероятность развития РМП у курящих мужчин выше на 50–60 %, а у женщин на 20–30 % по сравнению с некурящими [1, 2]. Имеется прямая связь между риском развития заболевания, количеством выкуриваемых сигарет, длительностью курения, видом табачной продукции [3]. Результаты метаанализа 216 клинических наблюдений продемонстрировали достоверную взаимосвязь для тех, кто курил ранее, и тех, кто продолжает курить [4]. Продолжительность воздержания после прекращения курения пропорционально сокращает риск развития заболевания. В случае немедленного отказа риск возникновения РМП в течение первых 4-х лет снижался на 40 % и на 60 % – в течение 25 лет [3].
Профессиональные и бытовые вредности
Взаимосвязь профессиональных вредностей с РМП известна более 100 лет. Было продемонстрировано, что у рабочих красильных и резиновых предприятий смертность от РМП в 30 раз выше, чем в популяции. Большинство канцерогенов – ароматические амины и их производные. В настоящее время установлено около 40 потенциально опасных производств: красильные, резиновые, каучуковые, нефтяные, алюминиевые, текстильные, с использованием смол, пластмасс и т.д. [5–8]. Имеются данные о повышенном риске развития РМП среди водителей автотранспорта. Так, в одном из исследований было установлено, что у водителей грузовиков относительный риск заболевания повышен в 1,17 раза, а у водителей автобусов – в 1,33 [8]. Отмечено повышение риска развития заболевания при потреблении воды с высоким содержанием мышьяка (Чили, Аргентина, Тайвань), побочными продуктами хлорирования, полученными при взаимодействии хлора с органическими веществами, содержащимися в воде, которые могут быть канцерогенами [5]. В работе Steinmaus C. и соавт. показано, что риск развития заболевания при потреблении хлорированной воды у мужчин возрастает в 1,8 раза, а у женщин – в 1,6 [9]. Нет убедительных данных о достоверном влиянии различных продуктов питания [10–13].
Лекарственные вещества
На возникновение РМП способны влиять следующие лекарственные вещества:
● анальгетики, содержащие фенацетин, – проведено несколько исследований, результаты которых доказали увеличение в 2,0–6,5 раза риска развития РМП при их постоянном применении. В настоящее время данный анальгетик и препараты, содержащие его, изъяты из обращения на территории РФ и многих других стран [5];
● циклофосфамид** – алкалоидное средство, применяющееся для лечения злокачественных опухолей. Результаты проведенных международных исследований продемонстрировали увеличение риска развития РМП более чем в 4,5 раза при его применении [5, 9];
● пиоглитазон – гипогликемическое синтетическое средство, используемое в лечении инсулино-независимого сахарного диабета. Не применяется в ряде стран по причине достоверных данных о риске возникновения РМП уже в течение первого года [14].
Радиация
Радиация увеличивает риск развития РМП у пациентов, перенесших облучение области таза по поводу рака цервикального канала, яичников, предстательной железы, в 1,5–4 раза и пропорционально величине дозы облучения. Наибольший риск развития заболевания выявлен у пациентов, перенесших облучение 5–10 лет назад. Для них характерно развитие высокодифференцированного инвазивного рака [15, 16]. Отмечено, что использование современных подходов облучения с модуляцией интенсивности пучка может улучшить эти показатели, однако требуются отдаленные результаты [17].
Шистосоматоз
Эндемичные районы: Ближний Восток, Юго-Восточная Азия, Северная Африка. Среди заболевших шистосоматозом РМП развивается чаще, чем в популяции. У мужчин риск развития заболевания повышается в 3,9 раза, у женщин — в 5,7 раз. Характерно развитие плоскоклеточного рака [5].
Хронический цистит
Риск развития РМП повышается у пациентов с хроническим циститом, с камнями мочевого пузыря, явлениями уростаза. Для пациентов с длительно стоящими в мочевом пузыре катетерами характерно повышение риска развития аденокарциномы мочевого пузыря [18].
РМП – наиболее часто встречающаяся злокачественная опухоль мочевыводящих путей и по распространенности занимает 7-е место в структуре онкопатологии у мужчин и 17-е место у женщин [19]. В зависимости от географического положения уровень заболеваемости РМП в разных странах отличается примерно в десятки раз. Так, в Западной Европе и США заболеваемость выше, чем в Восточной Европе и в странах Азии. В Европейском союзе стандартизованный по возрасту показатель заболеваемости составляет 19,1 для мужчин и 4,0 для женщин [20]. Во всем мире стандартизованный по возрасту коэффициент смертности (на 100 тыс. населения) составляет 3,2 для мужчин и 0,9 для женщин[21]. В структуре онкологической заболеваемости населения России РМП занимает 9-е место среди мужчин и 16-е – среди женщин. Показатель заболеваемости на 100 тыс. населения составил 13,2 для мужчин и 2,3 для женщин. Прирост заболеваемости для обоих полов за последние 10 лет составил 28,3 %. Стандартизованный показатель смертности для мужчин и женщин составил 4,7 и 0,5 соответственно [22]. По возрастному составу преобладают пациенты старше 60 лет, в России они составляют 78,4 %. Средний возраст заболевших в России мужчин – 66,6 года, женщин – 69,6 [22].
РМП встречается у мужчин чаще, чем у женщин (соотношение 3:1), что связано с бόльшим распространением среди мужчин курения и профессий, связанных с канцерогенными веществами, увеличивающими риск развития заболевания [23]. Имеются расовые различия в заболеваемости РМП. Так, в США среди чернокожих мужчин и американских индейцев она соответственно в 2 и 8 раз меньше, а в азиатских поселениях – на 60 % ниже, чем среди белых американцев [18].
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее – МКБ-10), рак мочевого пузыря имеет код:
C67– Злокачественное новообразование пузыря
Классификация МКБ-О (ВОЗ, 2016)
Инфильтративная уротелиальная карцинома 8120/3
Гнездная (в том числе крупногнездная)
Микрокистозная
Микропапиллярная 8131/3
Лимфоэпителиома-подобная 8082/3
Плазмацитоидная/перстневидноклеточная/диффузная
Саркоматоидная 8122/3
Гигантоклеточная 8031/3
Низкодифференцированная 8020/3
Богатая липидами
Светлоклеточная
Неинвазивные уротелиальные опухоли
Уротелиальная карцинома in situ 8120/2
Неинвазивная папиллярная уротелиальная карцинома
низкой степени злокачественности 8130/2
Неинвазивная папиллярная уротелиальная карцинома
высокой степени злокачественности 8130/2
Папиллярная уротелиальная опухоль
с низким злокачественным потенциалом 8130/1
Уротелиальная папиллома 8120/0
Инвертированная уротелиальная папиллома 8121/0
Уротелиальная пролиферация с неизвестным злокачественным потенциалом
Дисплазия уротелия
Плоскоклеточные опухоли
Чистая плоскоклеточная карцинома 8070/3
Веррукозная карцинома 8051/3
Плоскоклеточная папиллома 8052/0
Железистые опухоли
Аденокарцинома, БДУ 8140/3
– кишечная 8144/3
– муцинозная 8480/3
– смешанная 8140/3
Виллезная (ворсинчатая) аденома 8261/0
Карцинома урахуса 8010/3
Опухоли из эпителия Мюллерова типа
Светлоклеточная карцинома 8310/3
Эндометриоидная карцинома 8380/3
Нейроэндокринные опухоли
Мелкоклеточный нейроэндокринный рак 8041/3
Крупноклеточный нейроэндокринный рак 8013/3
Высокодифференцированная нейроэндокринная опухоль 8240/3
Параганглиома 8693/1
Классификация TNM (8-е издание)
Классификация TNM 2009 года, утвержденная Международным союзом по борьбе с раком (UICC), обновлена в 2017 г. (8-е издание), но без изменений в отношении опухолей мочевого пузыря [24].
Т – первичная опухоль
Добавление (m) должно быть сделано к соответствующей категории Т для указания
множественности поражения. Добавление (is) может быть сделано к категории Т для указания одновременного присутствия карциномы in situ.
− Т2а – опухолевая инвазия поверхностного мышечного слоя
− T2b – опухолевая инвазия глубокого мышечного слоя
− Т3а – микроскопически
− Т3b – макроскопически
− Т4а – опухолевая инвазия предстательной железы, или матки, или влагалища
− Т4b – опухолевая инвазия стенки таза или брюшной стенки
N – регионарные лимфатические узлы (ЛУ)
М – отдаленные метастазы
− М1а – метастазы в лимфатических узлах, не относящихся к регионарным
− М1b – другие отдаленные метастазы
Наличие лимфоваскулярной инвазии, а также инфильтрация ЛУ имеют независимое прогностическое значение [25, 26]. Предполагается, что категория pN напрямую связана с количеством удаленных ЛУ, правильной регистрацией относительно анатомических структур во время лимфаденэктомии, а также подробным изучением их патологом [28].
рTNM – патологоанатомическая классификация Категории рТ, рN, рМ соответствуют категориям T, N, M.
Группировка рака мочевого пузыря по стадиям представлена в табл. 1.
Таблица 1. Группировка рака мочевого пузыря по стадиям
| Стадия | Т | N | M |
|---|---|---|---|
| 0 | a, is | 0 | 0 |
| I | 1 | 0 | 0 |
| II | 2a–2b | 0 | 0 |
| III | 3a–4a | 0 | 0 |
| IV | 4b | 0 | 0 |
| Любая | 1–3 | 0 | |
| Любая | Любая | 1 |
Наличие инвазии опухоли в собственную пластинку слизистой оболочки имеет важное прогностическое значение [28, 29]. Причем тот факт, что в классификации ВОЗ от 2016 г. также активно обсуждается внедрение новых подстадий (Т1а–Т1b), является прямым доказательством этого [27, 30]. Однако оптимального решения по этому вопросу до настоящего времени не принято [27, 31].
Гистологическая классификация
Классификация ВОЗ (1973 г.)
Классификация ВОЗ (2004 г.): папиллярные новообразования
Классификация ВОЗ (2004 г.): плоские новообразования
PUNLMP – образование, у которого нет цитологических признаков малигнизации, а нормальные клетки уротелия объединяются в папиллярные структуры. Хотя эти опухоли обладают незначительным риском прогрессирования, они не являются абсолютно доброкачественными и имеют тенденцию к рецидивированию [32].
Умеренная степень дифференцировки (G2), которая была предметом дискуссий в классификации ВОЗ (1973 г.), удалена [33].
В течение длительного периода времени для классификации уротелиального рака мочевого пузыря использовались две класификации: ВОЗ (1973 г.) и ВОЗ (2004 г.) [34]. Однако в настоящее время Всемирная организация здравоохранения [27], СAP (College American Pathologist), ICCR (International Collaboration on Cancer Reporting) рекомендуют использовать классификацию 2004 г. – опухоли низкой степени злокачественности и опухоли высокой степени злокачественности.
Карцинома in situ (CIS) – плоская неинвазивная опухоль уротелия высокой степени злокачественности, характеризующаяся своей мультифокальностью с различными локализациями (МП, верхние мочевыводящие пути, протоки предстательной железы и уретра). При цистоскопии часто выглядит как участок воспаления. В случае однозначной оценки необходима биопсия [35]. Без лечения более чем у половины пациентов с CIS отмечается прогрессирование: мышечно-инвазивный рак либо метастазы. Выделяют следующие клинические типы CIS [36]:
При оценке наличия/отсутствия CIS в исследуемом материале существует значительная вариабельность среди врачей-патологоанатомов (от 20 до 30 %) [37] (УД 2).
Следует учитывать наличие лимфоваскулярной инвазии после ТУР. Данная ситуация характеризуется высоким риском прогрессирования [38–41] (УД 3). Некоторые гистологические варианты уротелиальной карциномы (микропапиллярный, плазмоцитоидный, саркоматоидный) наблюдаются редко (5–7 % случаев), но обладают худшим прогнозом, чем классическая уротелиальная карцинома [42–49] (УД 3). Изучаются различные маркеры РМП с определением их прогностической значимости [50–54]. Результаты многих исследований являются многообещающими, что приводит к выработке новых, комплексных подходов, основанных на молекулярной классификации. Однако в рутинной практике эти показатели еще не используются [55, 56].
Клинические проявления заболевания зависят от стадии РМП. Начальные стадии чаще всего протекают бессимптомно либо сходны с симптомами других заболеваний мочевыделительной системы, такими как ИМП, простатит, мочекаменная болезнь и т.д.
Безболевая гематурия является самым распространенным проявлением РМП. Отмечено, что макрогематурия связана с более высокой стадией заболевания по сравнению с микрогематурией при ее первом проявлении [57].
Учащенное и болезненное мочеиспускание с наличием императивных позывов, тазовая боль – все это может указывать на инвазивные, распространенные формы РМП. Однако в некоторых случаях такие жалобы могут являться симптомами CIS.
Появление боли в поясничной области связано с блоком устьев мочеточника опухолью и развитием гидронефроза. Боль в костях часто возникает при метастатическом поражении скелета. Симптомы, свидетельствующие о генерализации процесса: слабость, быстрая утомляемость, резкая потеря массы тела, анорексия.
Критерии установления диагноза/состояния:
Клинический диагноз основан на следующих результатах обследования:
Физикальный осмотр, данные анамнеза (макрогематурия) позволяют заподозрить новообразование мочевого пузыря.
Лабораторные исследования могут выявить наличие эритроцитов в моче.
Применение цистоскопии наиболее полно позволяет оценить состояние полости мочевого пузыря.
Заключение патолого-анатомического исследования опухолевого материала (биопсия новообразований).
Данные лучевых методов диагностики позволяют корректно стадировать заболевание.
Жалобы и анамнез описаны в разделе «Клиническая картина».
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: физикальное обследование включает в себя бимануальную ректальную и вагинальную пальпацию. Пальпируемая опухолевая масса может быть выявлена у пациентов с местно-распространенными опухолями. Во время наркоза, до и после проведения ТУР МП также целесообразно бимануальное исследование, чтобы оценить, имеется ли пальпируемая масса и фиксирована ли опухоль к стенке таза [58, 59]. Однако, учитывая несоответствие между бимануальным исследованием и стадией pT после цистэктомии (ЦЭ) (11 % клинической переоценки и 31 % недооценки), при интерпретации данных бимануального исследования рекомендуется соблюдать определенную осторожность [60].
При массивной гематурии имеются проявления анемии – бледность кожных покровов, слабость, вялость.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: при немышечно-инвазивных формах РМП бимануальные манипуляции нецелесообразны. В случае тампонады мочевого пузыря, острой задержки мочи переполненный МП пальпируется над лоном, а пациента беспокоят постоянные позывы на мочеиспускание, ощущение распирания в проекции мочевого пузыря, боль в надлобковой области. В то же время при увеличении объема опухоли снижается емкость МП, нарушается его резервуарная функция, что проявляется постоянными позывами на мочеиспускание с небольшим количеством выделяемой мочи, частичным недержанием. При блоке опухолью устья мочеточника и развитии гидронефроза положителен симптом поколачивания, пальпируется увеличенная почка. При местно-распространенном процессе информативна бимануальная пальпация МП, которая позволяет оценить размеры, подвижность опухоли, наличие инфильтрации окружающих тканей.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: наиболее адекватным материалом является взятие промывных вод при цистоскопии. ЦИ мочи имеет высокую чувствительность при T1 и G3 (84 %), в случае Та и G1 – низкую (16 %) [61]. Чувствительность при CIS составляет 28–100 % [62] (УД 1В). Данную методику необходимо использовать в качестве дополнения к цистоскопии. Тем не менее, стоит отметить, что положительные результаты цитологического исследования могут указывать на наличие опухоли в любом отделе мочевыводящих путей [63]. Однако, негативные результаты не исключают наличие опухоли [64].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: патоморфологическое исследование образца является важным в диагностике и лечении РМП. Требуется тесное сотрудничество между врачами-хирургами и врачами-патологоанатомами. Высокое качество предоставленной ткани и клиническая информация необходимы для правильной диагностической оценки. Наличие мышечной ткани в материале необходимо для правильного установления категории Т [82]. В сложных случаях следует рассмотреть вопрос о дополнительном пересмотре материала опытным врачом-патологоанатомом.
Важно наличие в направлении на патологоанатомическое исследование анамнестических и клинических данных: наличие рецидивов, химиотерапии, лучевой терапии, БЦЖ-терапии в анамнезе, локализация опухоли, уни- или мультицентрическое поражение.
В патологоанатомическом заключении после трансуретральной резекции мочевого пузыря следует указывать:
− гистологический тип опухоли;
− процент гетерологической дифференцировки (плоскоклеточной/ железистой/трофобластической и т.п.) и/или специфического подтипа уротелиальной карциномы при наличии
− гистологическую степень злокачественности опухоли (грейд)
− наличие инвазии в субэпителиальную строму и мышечный слой стенки
− наличие или отсутствие мышечного слоя
− наличие лимфоваскулярной инвазии
− наличие неинвазивной опухоли, карциномы in situ
− стадию по ТNM
− гистологический код по МКБ-О
Время холодовой ишемии (промежуток времени от прекращения кровообращения в органе до его адекватной фиксации) не должно превышать 2 часов. Операционный материал рекомендуется предварительно фиксировать в 10% нейтральном формалине в течение 10–12 часов перед забором фрагментов в гистологические кассеты (вырезкой). К предварительной фиксации образец необходимо подготовить: вскрыть просвет мочевого пузыря по передней стенке Т- или Y-образным разрезом от устья уретры и/или наполнить просвет мочевого пузыря формалином, перед его погружением в достаточный объем фиксирующей жидкости (в 10–20 раз превышающий объем образца). При макроскопическом исследовании оценивается максимальный размер опухоли и протяженность/глубина инвазии. Все доставленные с мочевым пузырем органы и их фрагменты (единым блоком/ или отдельно) должны быть описаны, измерены и исследованы гистологически.
В патологоанатомическом заключении после цистэктомии следует указывать:
– гистологический тип опухоли
– наличие гетерологической дифференцировки (плоскоклеточной/ железистой/ трофобластической и т.п.) и/или специфического подтипа уротелиальной карциномы и их долю от опухоли
– наличие неинвазивной опухоли, карциномы in situ
– гистологическую степень злокачественности опухоли (грейд)
– глубину инвазии (по данным микроскопического исследования)
– наличие лимфоваскулярной инвазии
– статус краев резекции
– количество удаленных и метастатически измененных лимфатических узлов
– стадию TNM
– гистологический код по МКБ-О.
Для патологоанатомического исследования биопсийного (операционного) материала необходимо использовать классификацию ВОЗ 2016 г. Необходимо указывать стадию и степень злокачественности опухолевого процесса при исследовании каждый раз, когда используется термин «немышечно-инвазивный РМП» [83]. Использовать термин «поверхностный РМП» не рекомендуется.
Цистоскопия
Диагностика папиллярных форм РМП напрямую зависит от цистоскопического исследования и гистологического заключения на основании холодовой, щипковой биопсии или ТУР-биопсии. В случае подозрения на CIS обязательным является также цитологическое исследование и выполнение множественной рандомной биопсии стенок МП [84].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: Цистоскопия может быть проведена как амбулаторная процедура. С помощью гибкого цистоскопа с трансуретральным введением местного анестетика достигается лучшая переносимость, особенно у мужчин. Для предупреждения пропуска опухоли должен быть выполнен тщательный осмотр всего эпителия, выстилающего полость МП. Если опухоль МП визуализирована при ранее выполненных визуальных методах исследования, диагностическую цистоскопию можно не выполнять, так как этим пациентам показано проведение ТУР [85, 86].
Диагностическая цистоскопия не должна заменять цитологическое исследование или какие-либо другие неинвазивные методы. При цистоскопии рекомендовано описать все макроскопические характеристики опухоли [87]:
Рекомендуется использовать схему строения МП [88]. При проведении диагностической уретроцистоскопии и выявлении новообразования рекомендована биопсия либо выполнение ТУР-биопсии.
Использование флюоресцентной цистоскопии позволяет более точно проводить исследование и более четко определять границы измененных участков, особенно при CIS [89, 90] (УД 1). ФД проводится в фиолетовом свете после внутрипузырной экспозиции фотосенсибилизатора аминолевулиновой кислоты (cенсибилизирующий препарат, используемый для фотодинамической/лучевой терапии). Чувствительность ФД составляет 80–96%, специфичность – 65–70 % [90, 91]. Такие факторы, как воспалительный процесс, ТУР, проведенная в ближайшие 3 мес., БЦЖ-терапия, снижают качество метода, увеличивая ложноположительные результаты [92, 93]. Другими исследованиями было подтверждено, что в опытных руках частота ложноположительных ответов при ФД была сопоставима с результатами цистоскопии в белом свете [26, 94].
Альтернативным вариантом может быть узкоспектральная визуализация (narrow band imaging, NBI), не требующая введения cенсибилизирующих препаратов, используемых для фотодинамической/лучевой терапии. Благодаря специальным фильтрам увеличивается контрастность между неизмененной слизистой и гиперваскулярной опухолевой тканью [95]. Когортные проспективные исследования продемонстрировали преимущество данного метода при выявлении рецидивов, а также более прецизионное выполнение на его фоне ТУР [96–98]. Однако рандомизированные исследования не показали достоверной разницы в выявлении рецидивов, а также преимуществ данного метода при оценке прогрессирования и смертности [99].
Биопсия
При визуализации подозрительных участков, в случае положительной цитологии, при динамическом контроле, особенно если в анамнезе были ТУР по поводу CIS или T1G3, – во всех случаях показана холодовая биопсия как отдельных участков, так и всех стенок МП [100, 101].
− треугольник Льето;
− верхушка мочевого пузыря;
− правая, левая, передняя и задняя стенки МП;
− простатический отдел уретры.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Биопсия простатического отдела уретры особенно целесообразна в случаях, когда имеется CIS, локализованная в области треугольника или детрузора, а также при высоком риске T1G3. Представленные Palou и соавт. результаты продемонстрировали, что у пациентов с T1G3 частота обнаружения сопутствующей CIS в простатической части уретры составила 11,7 % [102, 103].
ТУР-биопсия является наиболее информативным вариантом биопсии. Пациенту проводится трансуретральное удаление части опухоли мочевого пузыря с подлежащим мышечным слоем и последующей оценкой глубины инвазии [104]. Также при ТУР-биопсии можно более точно оценить первичную опухоль, а именно ее вертикальные и горизонтальные размеры, используя при этом резекционную петлю [105]. Ширина петли составляет до 1 см.
Ультразвуковая диагностика
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: УЗИ проводят трансабдоминально, трансректально (у женщин –трансвагинально) при наполненном МП. Необходимо выполнять УЗИ печени и парааортальной зоны при высокой вероятности распространенного процесса. Информативность метода резко снижается при опухолях размером менее 5 мм, а также при стелющемся и инфильтративном характере роста опухоли, при фиксированном внутрипузырном сгустке, при отеке стенки пузыря. По эффективности выявления и оценке распространенности опухоли мочевого пузыря метод УЗИ уступает магнитно-резонансной (МРТ) и компьютерной томографии с контрастным усилением [106].
Компьютерная, магнитно-резонансная и позитронно-эмиссионная томография
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 1).
– МРТ малого таза (согласно рекомендаций VI-RADS) и брюшной полости с контрастированием (как альтернатива – КТ брюшной полости и малого таза с контрастированием). При отсутствии признаков местного и регионарного поражения по данным МРТ (КТ) расширение объема исследования не требуется, рекомендуется проведение рентгенографии органов грудной клетки;
– МРТ малого таза (согласно рекомендаций VI-RADS) и брюшной полости с контрастированием (как альтернатива – КТ брюшной полости и малого таза с контрастированием). При получении сведений за регионарное распространение по данным МРТ (КТ) требуется расширение объема исследования – КТ грудной полости [107-112].
– Проведение МРТ головного мозга целесообразно только при наличии неврологической симптоматики, указывающей на метастазирование в ткань и оболочки головной мозг [112, 113].
– Позитронно-эмиссионная томография всего тела, совмещенная с КТ (ПЭТ/КТ), может использоваться как дополнительный метод обследования при подозрении на отдаленные метастазы при стадии Т>2. ПЭТ/КТ не используется для Т-стадирования и определения распространённости опухоли по мочевыводящему тракту [114]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Во всех случаях пациентам с подозрением на РМП целесообразно начинать исследование с МРТ малого таза по специальной методике (рекомендации VI-RADS) для оценки вероятности мышечной инвазии согласно критериев VI-RADS (как менее информативная альтернатива – КТ с контрастным усилением). Лучевые исследования лучше проводить до цистоскопии и внутрипузырных манипуляций, т.к. информативность в первые 7 дней после этого снижается [107, 108]. При этом следует понимать, что метод МРТ ограничен в визуализации опухолей Та-Т1 и выявлении признаков микроскопической инвазии за пределы стенки (Т3а) [109].
Следует понимать, что при правильно проведенном МРТ-сканировании (согласно рекомендациям VI-RADS) возможно визуализировать слои стенки мочевого пузыря, а также четко дифференцировать границы и структуру других органов малого таза в отличии от КТ. Поэтому МРТ обладает высокой чувствительностью и специфичностью в определении глубокой инвазии рака мочевого пузыря – около 90 %. Особенно высокие показатели зарегистрированы на приборах с индукцией магнитного поля (напряженностью) 3,0 Тл [110, 111]. Оба метода (КТ и МРТ) примерно одинаково эффективны в оценке поражения лимфатических узлов и висцеральных очагов на основе критерия максимального поперечника (8 мм – для тазовых и 10 мм – для абдоминальных групп лимфатических узлов). Проведение МРТ головного мозга целесообразно только при наличии неврологической симптоматики, указывающей на метастазирование в ткань и оболочки головной мозг [112, 113].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: наследственный РМП встречается в недифференцированной когорте пациентов с частотой около 0,5-1% и относится, в основном, к проявлениям синдрома Линча – наследственного онкологического синдрома, который обусловлен мутацией в одном из генов системы репарации неспаренных нуклеотидов (MMR – mismatch repair deficiency): MLH1, MSH2, MSH6, PMS1, PMS2 или EPCAM. При этом синдроме в порядке убывания по частоте встречаемости описаны колоректальный рак, эндометриоидный рак, рак яичников, рак желудка, уротелиальные карциномы различных отделов мочевыделительной системы, рак предстательной железы и некоторые другие типы опухолей. РМП чаще развивается при мутации в MSH2. На наследственный характер заболевания может указывать молодой возраст пациента, неблагоприятный семейный онкологический анамнез, первично-множественные опухоли, в анамнезе пациента – новообразования в других органах-мишенях синдрома Линча. Молекулярно-генетическая диагностика заключается в анализе микросателлитной нестабильности, высокую степень которой (статус MSI-H) рассматривают как вероятное подтверждение заболевания. Минимальная панель из 5 мононуклеотидных STR-маркеров, зачастую используемая при колоректальном раке, в опухолях других типов обладает недостаточной чувствительностью. В связи с этим статус MSI-H в уротелиальных карциномах следует определять с помощью ИГХ-анализа и выявления потери экспрессии одного из ключевых участников системы репарации неспаренных оснований: MLH1, MSH2, MSH6 или PMS2 [312]. В случае выявления MSI-H наиболее информативным генетическим исследованием является определение герминальной мутации в генах-кандидатах синдрома Линча с помощью высокопроизводительного секвенирования (ВПС, англ. аналог – NGS, next generation sequencing) панели генов MMR. В отдельных случаях РМП может развиваться у носителей герминальных мутаций в генах BRCA1/2, MUTYH, RB1 и некоторых других. Если молодой пациент не удовлетворяет диагностическим критериям синдрома Линча, то ему может быть выполнено ВПС экзома или мультигенной онкологической панели [313].
Иные диагностические исследования могут понадобиться для дифференциальной диагностики РМП со следующими заболеваниями:
Выбор метода лечения уротелиального рака, прежде всего, определяется наличием метастазов, глубиной инвазии первичной опухоли, ее грейдом и сопутствующей CIS. Важными факторами, влияющими на лечебную тактику, являются локализация и количество опухолевых очагов. При индивидуальном выборе метода лечения больных уротелиальным раком также принимаются во внимание функциональная сохранность пораженного участка мочевыводящих путей, коморбидный фон и ожидаемая продолжительность жизни.
Клинически уротелиальный рак можно разделить на 3 категории, которые принципиально различаются по прогнозу, видам и целями лечения. К первой категории относятся немышечно-инвазивные опухоли, лечение которых направлено на радикальное удаление новообразования, снижение риска рецидива и предотвращение опухолевой прогрессии в мышечно-инвазивный уротелиальный рак.
Вторая группа включает мышечно-инвазивные уротелиальные карциномы. Целью их лечения является радикальное удаление опухоли, снижение риска метастазирования и поддержание качества жизни за счет сохранения пораженного органа. Органосохраняющее лечение возможно только в случаях, когда это не приведет к снижению выживаемости. В зависимости от индивидуального риска диссеминации мышечно-инвазивного уротелиального рака принимается решение о необходимости назначения системной противоопухолевой терапии.
К третьей группе уротелиальных раков относятся неоперабельные местно-распространенные и диссеминированные формы заболевания. Целью лечения этой категории больных является увеличение продолжительности и сохранение качества жизни за счет последовательного применения противоопухолевых препаратов различного механизма действия и их комбинаций.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: При ТУР МП удаляют все видимые опухоли. Отдельно удаляют экзофитный компонент и основание опухоли. Это необходимо для правильного установления стадии заболевания (рТ), так как в зависимости от полученных результатов вырабатывают дальнейшую тактику лечения пациента. Проведение ТУР МП с последующим патоморфологическим исследованием – главный этап в лечении НМИ РМП. Целью лечения в данном случае является удаление существующей опухоли с профилактикой рецидива заболевания и предотвращением развития инфильтративной опухоли.
Наиболее распространенными осложнениями ТУР МП являются:
➢ кровотечения (интраоперационные и послеоперационные), иногда требующие открытого хирургического вмешательства;
➢ перфорация стенки мочевого пузыря (внутрибрюшинная перфорация требует лапаротомии или лапароскопии, дренирования брюшной полости, ушивания дефекта стенки мочевого пузыря).
− после неполной первоначальной ТУР – для исключения опухолей TaG1 и первичного РМП, если после первоначальной резекции в образце не было мышечной ткани;
− во всех случаях опухолей Т1;
− при всех опухолях G3 [118–122].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Проведение повторной ТУР является обязательной манипуляцией у пациентов группы высокого риска. Исследования демонстрируют достоверные различия в безрецидивной выживаемости и выживаемости без прогрессии [118–121]. Повторная ТУР выполняется через 2–6 недель после первичной процедуры [122].
При некоторых экзофитных опухолях возможна резекция единым блоком (en bloc) с использованием моно- или биполярного тока, а также современных методов: лазеров (тулиевый и гольмиевый) Такая методика обеспечивает высокое качество морфологического материала с наличием мышечного слоя в 96–100% случаев [123–126].
При использовании ТУР можно полностью удалить макроопухоль, но невозможно повлиять на микроочаги. В результате возникают рецидивы, которые могут в дальнейшем прогрессировать до МИ РМП [117]. Поэтому необходимо рассмотреть вопрос об адъювантной терапии у всех пациентов [211].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: При лечении пациентов с НМИ РМП с высокой вероятностью развития рецидива в первые 3 мес. наблюдения рекомендуется рассматривать назначение адъювантной терапии. Применение внутрипузырной химиотерапии приводит к снижению рецидивов, увеличению продолжительности безрецидивного течения, однако не сказывается на частоте прогрессирования процесса и показателях выживаемости [212].
Ранняя послеоперационная инстилляция не проводится в случаях явной или предполагаемой перфорации стенки мочевого пузыря, а также при гематурии, когда требуется промывание полости МП. В данном случае среднему медицинскому персоналу необходимо давать четкие инструкции по контролю свободного оттока жидкости по мочевому катетеру. Необходимость в проведении адъювантной внутрипузырной терапии зависит от прогноза рецидива заболевания[213].
В группе пациентов низкого риска немедленная однократная химиотерапия проводится в качестве полной (завершенной) адъювантной терапии. Данной категории пациентов не требуется лечения до последующего рецидива [214]. Однако для других групп риска однократная немедленная инстилляция является недостаточной из-за высокой вероятности развития рецидива и/или прогрессирования.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: Длительность экспозиции химиопрепарата также регламентирована. При сравнении 0,5 и 1-часовой экспозиций достоверной разницы в безрецидивной выживаемости не отмечено [254].
Выбор тактики дальнейшего лечения и наблюдения определяетя на основании таблиц и номограмм, предложенных Европейской ассоциацией по изучению и лечению рака в 2006г. [127]. В зависимости от прогностических факторов возникновения рецидива и прогрессии у пациентов с НМИ РМП рекомендована выработка дальнейшей тактики лечения [127].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарии: группа низкого риска – уровень инвазии рТа, дифференцировка G1, единичная опухоль менее 3 см, отсутствие CIS. Риск рецидива и прогрессирования опухоли в данной группе за 5 лет – до 37 и 1,7 % соответственно. Смертность за 10 лет – 4,3 %.
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарии: к этой группе относятся все пациенты, не вошедшие в группу низкого или высокого риска. Риск рецидива и прогрессирования опухоли за 5 лет – до 65 и 8 % соответственно. Смертность за 10 лет – 12,8 %.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: группа высокого риска – уровень инвазии рТ1, дифференцировка G3, множественные и рецидивные опухоли; CIS, а также большие опухоли (более 3 см), pTaG1–2 при возникновении рецидива в течение 6 мес. после операции. Эта группа прогностически неблагоприятная. Эффективность внутрипузырной химиотерапии значительно ниже. Вариант выбора у данных пациентов при неэффективности комбинированного органосохраняющего лечения – ЦЭ. Риск рецидива и прогрессирования опухоли за 5 лет – до 84 и 55 % соответственно. Смертность за 10 лет – 36,1 %. Индукционные инстилляции вакцина для иммунотерапии рака мочевого пузыря** классически выполняются в соответствии с эмпирической 6-недельной схемой, которая была предложена Morales и соавт. [200].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: в мета-анализе положительный эффект наблюдался только у пациентов, получивших БЦЖ-терапию по поддерживающей схеме. Используется много различных поддерживающих режимов: от 10 инстилляций, проведенных в течение 18 недель, до 27 более чем за 3 года. С помощью мета-анализа невозможно было определить, какая поддерживающая схема вакцины была наиболее эффективной. Преимущество иммунотерапии перед митомицином** в предупреждении развития рецидива и прогрессирования появляется только при применении БЦЖ-терапии продолжительностью не менее 1 года. Оптимальное количество, частота и длительность поддерживающих индукционных инстилляций остаются неизвестными. Однако результаты рандомизированного контролируемого исследования, куда вошли 1355 пациентов, показали, что проведение поддерживающей БЦЖ-терапии в течение 3 лет с использованием полной дозы вакцины снижает частоту рецидивирования по сравнению с 1 годом лечения в группе высокого риска, но это не относится к пациентам с промежуточным риском. Не наблюдалось различий при сравнении показателей прогрессирования или общей выживаемости [200–204].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: первые инстилляции проводятся через 3–4 нед. после ТУР. Вакцина для иммунотерапии рака мочевого пузыря**: 50–100 мг в 50мл физиологического раствора натрия хлорида**. Вводится еженедельно, в течение 6 нед, далее – ежемесячно на протяжении 1 года, либо по схеме: 3 недельные циклы каждые 3, 6, 12, 18, 24, 30, 36 мес. При БЦЖ-рефрактерных опухолях целесообразно выполнение радикальной ЦЭ.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: наличие лейкоцитурии или асимптоматической бактериурии не является противопоказанием для проведения БЦЖ-терапии, в этих случаях нет необходимости в проведении антибиотикопрофилактики. Системные осложнения могут развиться после системной абсорбции лекарственного препарата. Таким образом, следует учитывать противопоказания к внутрипузырной инстилляции [205, 206].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: БЦЖ-терапия относительно противопоказана у иммунокомпрометированных пациентов (иммуносупрессия, ВИЧ-инфекция). Серьезные побочные эффекты встречаются менее чем у 5 % пациентов и в большинстве случаев могут быть эффективно излечены. Показано, что поддерживающая схема лечения не ассоциирована с повышенным риском побочных эффектов в сравнении с индукционным курсом терапии. Некоторые небольшие исследования показали аналогичную эффективность и отсутствие увеличения количества осложнений по сравнению с не иммунокомпрометированными пациентами. В связи с тем, что БЦЖ-терапия слабо влияет на опухоли с низким риском развития рецидива, рекомендовано рассматривать ее как излишнее лечение для этой когорты пациентов [210].
Также отмечено, что у БЦЖ-терапии больше побочных эффектов, чем у ХТ. По этой причине оба вида лечения (БЦЖ-терапия и внутрипузырная ХТ противоопухолевыми антибиотиками) остаются возможными методами терапии. При окончательном его выборе следует учитывать риск рецидивирования и прогрессирования для каждого пациента в отдельности так же, как и эффективность и побочные эффекты любого метода лечения.
В случае выявления БЦЖ-рефрактерной опухоли не рекомендовано дальнейшее консервативное лечение с применением вакцины
Альтернативой БЦЖ-терапии у отобранных больных может служить внутрипузырная химиотерапия. Остается спорным вопрос о продолжительности и частоте инстилляций химиопрепаратов. Из систематического обзора литературных данных по изучению РМП, где сравнивались различные режимы внутрипузырных инстилляций химиопрепаратов, можно сделать вывод, что идеальная продолжительность и интенсивность режимов остаются неопределенными из-за противоречивых результатов. Имеющиеся данные не подтверждают эффективность проведения лечения продолжительностью более 1 года [218].
Адаптация рН мочи, снижение дилюции с целью сохранения концентрации химиопрепарата снижают частоту рецидивов и являются важными условиями правильно проведенной инстилляции [216, 217]. При проведении внутрипузырной химиотерапии необходимо использовать лекарственные препараты при оптимальной рН мочи и поддерживать концентрацию препарата в течение экспозиции на фоне снижения потребления жидкости.
Схемы проведения внутрипузырной химиотерапии:
Внутрипузырная химиотерапия не проводится на протяжении более чем 1 года всем пациентам НМИ РМП вне зависимости от групп риска [219].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: после внутривенного введения фотосенсибилизатора (cенсибилизирующего препарата, используемого для фотодинамической/лучевой терапии) с помощью лазера проводят обработку слизистой оболочки МП. В ряде работ сообщается об уменьшении количества рецидивов после фотодинамической терапии; в настоящее время осуществляются отработка схем и накопление материала. Дозы препаратов, сроки и режимы лечения зависят от распространенности опухоли по слизистой оболочке МП, характера фотосенсибилизатора и доз лазерного излучения.
Обоснованием радикальной цистэктомии как тактики лечения немышечно-инвазивного рака мочевого пузыря являются:
– несоответствие категории рТ1 после ТУР и последующей ЦЭ регистрируется у 27-51% пациентов [137–140];
– худший прогноз у пациентов с прогрессией до МИ РМП, по сравнению первичным МИ РМП [141–142].
У пациентов с НМИ РМП выделяют срочную (незамедлительную) радикальную цистэктомию – сразу после установления диагноза РМП без инвазии в мышечный слой и раннюю радикальную цистэктомию – после неэффективной БЦЖ-терапии. Ретроспективно показано, что пациентам РМП с высоким риском развития рецидива лучше провести раннюю, чем отсроченную, ЦЭ при выявлении рецидива опухоли после первоначального лечения с использованием ТУР и БЦЖ-терапии, тем самым улучшая результаты выживаемости [127, 132, 143].
Необходимо учитывать влияние радикальной ЦЭ на качество жизни пациентов. Потенциальный положительный эффект от радикальной ЦЭ должен быть соизмеримым с возможными рисками и показателями заболеваемости.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Комментарии: группа высочайшего риска включает пациентов со следующими характеристиками: уровень инвазии рТ1G3 с CIS; множественные, рецидивные опухоли больших размеров; pT1G3 с CIS в простатическом отделе уретры; редкие гистологические варианты опухоли с плохим прогнозом; опухоли Т1 с лимфоваскулярной инвазией. Эта группа прогностически наиболее неблагоприятная. При отказе пациента от ЦЭ показана БЦЖ-терапия с поддерживающим режимом в течение 3 лет.
При отказе или противопоказаниях к радикальной цистэктомии возможно проведение повторного курса терапии вакциной для иммунотерапии рака мочевого пузыря**.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Комментарии: отсрочка в выполнении радикальной ЦЭ может привести к снижению показателей выживаемости. У пациентов с НМИ РМП после радикальной ЦЭ показатели 5-летней безрецидивной выживаемости превышают 80 % [144–146].
В случае неадекватного лечения более 50 % пациентов с ранее выявленной CIS прогрессируют в мышечно-инвазивный (МИ) РМП [128]. Считается, что сочетание pТ1G2–3 и CIS имеет более худший прогноз по сравнению с первичной или распространенной CIS и CIS простатического отдела уретры [102, 129–131].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: БЦЖ-терапия должна включать индукционный курс и поддерживающий режим в течение 1–3 лет.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: пембролизумаб** изучался при БЦЖ-рефрактерной CIS мочевого пузыря в несравнительном исследовании в связи с отсутствием стандартного консервативного лечения, имеющего доказанную эффективность у подобной категории больных. В когорту А однорукавного многоцентрового исследования II фазы KEYNOTE-057 вошел 101 пациент с БЦЖ-рефрактерной CIS мочевого пузыря с или без папиллярной опухоли, имеющий противопоказания к радикальной цистэктомии или отказавшийся от нее. Гиперэкспрссия PD-L1 (≥10% по шкале CPS) имела место в 38% случаев. Всем пациентам проводилась монотерапия пембролизумабом** (200 мг 1 раз в 3 недели, в/в капельно) с оценкой эффекта каждые 3 месяца (цистоскопия, биопсия и цитологическое исследование мочи). Запланированная длительность лечения составляла 24 месяца. Терапию завершали преждевременно при выявлении персистирующего или рецидивного немышечно-инвазивного рака мочевого пузыря высокого риска, опухолевой прогрессии, метастазирования или при развитии непереносимой токсичности. Первичной целью исследования являлась частота объективных ответов. Частота полных ответов, зарегистрированных через 3 месяца терапии, составила 39%. Медиана длительности полного ответа равнялась 16,2 месяца. При медиане наблюдения 36,4 месяца случаев опухолевой прогрессии в мышечно-инвазивный рак не зарегистрировано. Частота нежелательных явлений 3-4 степеней тяжести составила 13% [320].
Радикальная ЦЭ является стандартным методом лечения, локализованного МИ РМП [143, 147]. Современное состояние проблемы все чаще требует более индивидуального подхода в лечении инвазивных и распространенных форм РМП. Оценка качества жизнь, работоспособность, ожидаемая продолжительность жизни, общее состояние пациента на момент операции – все это формирует новые тенденции в терапии, такие как комбинированные варианты химиолучевого лечения и органосохраняющей операции [148, 149].
Время от момента постановки диагноза до момента проведения операции точно не установлено, однако имеются данные, что выживаемость была выше в группе пациентов, которым выполнили операцию в течение 90 дней [150–152] (УД 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Показатели смертности ниже в центрах с большим опытом выполнения радикальной ЦЭ, общая 5-летняя выживаемость после ЦЭ составляет в среднем 40-60% [153]:
− рТ1 – 75-83%;
− рТ2 – 63-70%;
− рТ3a – 47-53%;
− рТ3b – 31-33%;
− рТ4 – 19-28%.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: общее количество осложнений ЦЭ составляет 9,7-30,0%. Частота гнойно-септических осложнений достигает 0,28-30%. Летальность после операции – 1,2-5,1%. Интраоперационные осложнения достигают 5,3–9,7%. Кровотечения составляют 3–7%. Ранения прямой кишки при наличии лучевой терапии в анамнезе – 20-27%, без лучевой терапии – 0,5-7,0 %.
Наиболее распространенные послеоперационные осложнения [157]:
− лимфорея – 0-3 %;
− кишечная непроходимость – 1-5 %;
− желудочно-кишечные кровотечения – 1,5-2 %;
− поздние послеоперационные осложнения в виде эректильной дисфункции – в 30-85 % случаев;
− лимфоцеле – 0,1-2,6 %;
− грыжи передней брюшной стенки – в 1,5-5,0 % случаев.
Наличие только одного метастатического ЛУ (N1) не препятствует выполнению ортотопической пластики, но не в случае N2-3 [158].
У мужчин объем радикальной ЦЭ включает: удаление единым блоком (en bloc) мочевого пузыря с участком висцеральной брюшины и паравезикальной клетчаткой, предстательной железой и семенными пузырьками; тазовую (подвздошно-обтураторную) лимфаденэктомию. При опухолевом поражении простатической части уретры рекомендовано выполнение уретерэктомии [159, 160]. Также у мужчин возможно проведение нервосберегающей операции с сохранением кавернозных сосудисто-нервных пучков с целью профилактики развития эректильной дисфункции [159].
Женщинам рекомендован объем радикальной ЦЭ, включающий переднюю экзентерацию таза и двустороннюю тазовую лимфаденэктомию: удаление мочевого пузыря с участком висцеральной брюшины и паравезикальной клетчаткой, удаление матки с придатками, резекцию передней стенки влагалища [160].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: объем тазовой лимфодиссекции включает в себя удаление ЛУ в области наружных и внутренних подвздошных сосудов, в обтураторной ямке, а также пресакральных ЛУ. Расширенная лимфодиссекция также подразумевает удаление ЛУ в области общих подвздошных сосудов до верхней границы – бифуркации аорты. Если краниальной границей служит нижняя брыжеечная артерия, то лимфодиссекция является суперрасширенной [161–165]. Оптимальный объем лимфаденэктомии не определен, однако преимущественное число рандомизированных исследований демонстрирует целесообразность выбора в пользу расширения границ лимфодиссекции как по показателям выживаемости без рецидива и прогрессии, так и по общей выживаемости [166–172].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Целесообразно сохранение уретры при отсутствии позитивного хирургического края.
Использование лапароскопической техники достаточно давно внедрено в практику и имеет большое количество публикаций, посвященных малоинвазивной методике. Эра робот-ассистированных операций – самая молодая среди всех существующих, однако число печатных работ по этой технологии конкурирует с таковыми по лапароскопии [174- 176]. Стоит отметить, что большинство представленных данных имеет низкий уровень доказательности – 4. По-видимому, это обусловлено некорректной стратификацией пациентов [174]. Лапароскопическая и робот-ассистированная ЦЭ рекомендованы к применению у пациентов с РМП, однако до сих пор остаются в фазе изучения. Лапароскопическая и робот-ассистированная техника могут применяться для лечения пациентов как с НМИ, так и с МИ РМП.
Радикальная ЦЭ включает два непрерывных этапа: удаление мочевого пузыря с лимфодиссекцией и реконструктивно-пластический компонент. Вторым непрерывным этапом и является выбор способа деривации мочи [177]. Возраст >80 лет является противопоказанием к формированию резервуара [178].
Классификация видов деривации мочи:
− наружное отведение мочи (уретерокутанеостомия, кишечная пластика с формированием «сухих» и «влажных» стом);
− создание мочевых резервуаров, обеспечивающих возможность самостоятельного контролируемого мочеиспускания: орто- и гетеротопическая пластика мочевого пузыря;
− отведение мочи в непрерывный кишечник (уретеросигмостомия, операция Mainz-pouch II).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: тип отведения мочи не оказывает влияния на онкологические результаты. Не рекомендуется проведение лучевой терапии до оперативного вмешательства при выборе метода лечения с отведением мочи
Уретерокутанеостомия
У пациентов пожилого возраста или имеющих выраженные сопутствующие патологии предпочтительным методом является уретерокутанеостомия. Время операции, частота осложнений, пребывание в реанимации и длительность нахождения в стационаре ниже у пациентов после выведения мочеточников на кожу [179, 180]. При наружном отведении мочи пациенту необходимы мочеприемники.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: существует вероятность стеноза уретерокутанеостомы ввиду малого диаметра самой стомы.
Основные осложнения после операции:
− пиелонефрит;
− хроническая почечная недостаточность;
− стеноз устьев мочеточников (при формировании уретеро-уретероанастомоза «конец-в-бок»);
− стеноз стомы;
− кожные изменения вокруг стомы (мацерация, грибковое поражение).
Гетеротопический илеокондуит
Данный вариант формирования мочевого резервуара с выведением участка подвздошной кишки и формированием кутанеостомы является наиболее изученным и часто используемым. Тем не менее частота ранних послеоперационных осложнений достигает 48 %. Пиелонефрит как наиболее частое осложнение наблюдается в 30–50 % случаев [181].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: наиболее часто встречающиеся осложнения [182–184]:
− пиелонефрит;
− кишечная непроходимость;
− стеноз мочеточниково-резервуарных анастомозов;
− стеноз стомы;
− кожные изменения вокруг стомы (мацерация, грибковое поражение).
Гетеротопический илеокондуит («сухая» стома)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Хорошее удерживание мочи в дневное и ночное время отмечено многими пациентами и достигает 90% [188]. Стеноз аппендикулярной стомы встречается в 15-23% случаев [189]. Выбор данного варианта реконструктивной пластики является достаточно трудоемким и требует навыка и опыта хирурга [190].
Ортотопический резервуар
Формирование ортотопического резервуара предполагает его расположение в полости таза, на месте удаленного МП, и создание резервуарно-уретрального анастомоза. Этот метод позволяет пациенту в дальнейшем самостоятельно контролировать акт мочеиспускания [147,190,191].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: женщинам также возможно выполнение ортотопической пластики при условии тщательно изученной шейки мочевого пузыря (биопсия с целью выявления опухолевых участков) [192].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: противопоказания для операции – опухолевое поражение уретры ниже семенного бугорка; выраженная хроническая почечная недостаточность.
Наиболее частые осложнения [193]:
− дневное недержание мочи (5,4-30,0%);
− ночное недержание мочи (18,6-39,0%);
− пиелонефрит;
− метаболические осложнения (гиперхлоремический ацидоз);
− конкрементообразование;
− стриктура резервуарно-уретрального анастомоза.
Органосохраняющее лечение мышечно-инвазивного рака мочевого пузыря направлено на сохранение пораженного органа и, как следствие, качества жизни пациентов без ухудшения выживаемости.
– солитарная опухоль мочевого пузыря, вне его шейки;
– категория рТ2a–b;
– грейд G1–2 или LG;
– отсутствие гидронефроза, обусловленного опухолью;
– хорошая функция мочевого пузыря до лечения;
– нормальный показатель ПСА (исследование общей и свободной фракции крови);
– отрицательный результат мультифокальной биопсии предстательной железы (опционально);
– отсутствие в анамнезе указаний на резекцию мочевого пузыря, или чреспузырную аденомэктомию, или чреспузырное удаление конкрементов мочевого пузыря;
– отсутствие в анамнезе указаний на лучевую терапию на область малого таза;
– отсутствие протяженных стриктур мочеиспускательного канала;
– противопоказания к РЦЭ [195-198].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: только ТУР мочевого пузыря, только ХТ или только ЛТ существенно уступают радикальной цистэктомии с НХТ или АХТ в отношении онкологических результатов, в связи с чем не рекомендуются к использованию в широкой клинической практике [148,149].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: наиболее эффективным методом органосохраняющего лечения, который может использоваться у тщательно отобранных больных, является трехмодальная терапия, подразумевающая выполнение максимальной ТУР мочевого пузыря с последующим проведением химио-лучевой терапии (ХЛТ). Обоснованием сочетания ТУР с ЛТ является необходимость достичь полного локального контроля над первичной опухолью и регионарными лимфатическими коллекторами. Введение в схему лечения радиосенсибилизирующих цитостатиков (cенсибилизирующих препаратов, используемых для фотодинамической/лучевой терапии) направлено на усиление эффекта облучения, а также потенциально способно элиминировать микрометастазы.
В составе трехмодального лечения описаны разные схемы ХТ, включая монотерапию цисплатином** [314], а также монотерапию гемцитабином** [315]. В рандомизированном исследовании II фазы два ежедневных сеанса облучения с комбинированной ХТ (фторурацил** и цисплатин**) и один сеанс ежедневного облучения с монотерапией гемцитабином** продемонстрировали сопоставимую 3-летнюю выживаемость без отдаленных метастазов (78% и 84% соответственно) при большей частоте гематологических НЯ 4 степени тяжести в группе полихимиотерапии [316].
Пятилетняя специфическая и общая выживаемость больных, подвергнутых трехмодальной терапии, колеблется от 50% до 82% и от 36% до 74%, соответственно [314, 316]. Большинство рецидивов рака мочевого пузыря не инвазирует детрузор и может быть излечено консервативно. Спасительная цистэктомия требуется примерно у 10-15% пациентов, получавших трехмодальное лечение. Отдаленные результаты спасительных операций сопоставимы с результатами первичных радикальных цистэктомий, хотя частота осложнений у облученных пациентов выше [317].
Рандомизированных исследований, сравнивающих радикалную ЦЭ и трехмодальное лечение, не проводилось. Cистематический обзор, включивший данные более 30 000 пациентов из 57 исследований, не выявил достоверных различий выживаемости между больными, подвергнутыми радикальной ЦЭ и трехмодальной терапии. Однако при сроке наблюдения 10 лет специфическая и общая выживаемость оказались выше у пациентов с сохраненным мочевым пузырем [318]. Профиль безопасности трехмодальной терапии благоприятный. Комбинированный анализ данных пациентов, входивших в 4 исследования RTOG, показал, что при медиане наблюдения 5,4 года частота поздней гастроинтестинальной и мочевой токсичности 3 степени тяжести составляет 1,9% и 5,7% соответственно; нежелательных явлений 4 степени тяжести не зарегистрировано [319]. Ретроспективные данные показали преимущество качества жизни пациентов, подвергнутых трехмодальной терапии, по сравнению с больными, перенесшими РЦЭ [86].
Наиболее часто используемые режимы химиолучевой терапии в составе трехмодального лечения приведены в таблице 2 [314-316, 323].
Таблица 2. Режимы химиолучевой терапии рака мочевого пузыря.
| Режим химиотерапии | Режим лучевой терапии | Источник |
|---|---|---|
| #Цисплатин** 100 мг/м2 в/в в 1-й, 15-й, 29-й дни | СОД 60–66 Гр (30–33 фракции), 6 нед. | [314] |
| #Цисплатин** 40 мг/м2 в/в еженедельно 6 введений | СОД 60–66 Гр (30–33 фракции), 6 нед. | [315] |
| #Гемцитабин** 27 мг/м2 в/в 1-й и 4-й дни каждой недели (интервал не менее 72 часов) | СОД 60–66 Гр (30–33 фракции), более 4 нед. | [316] |
| #Цисплатин** 15 мг/м2 в/в в 1–3-й, 8–10-й и 15–17-й дни + фторурацил** 400 мг/м2 в/в в 1–3-й, 8–10-й и 15–17-й дни | ЛТ два раза в день, СОД 64,3 Гр | [323] |
Схемы химиотерапии и иммунотерапии, применяемые при инвазивном и метастатическом РМП и используемые в данном разделе:
гемцитабин** – 1000 мг/м2 в/в в 1-й, 8-й и 15-й день
цисплатин** – 70 мг/м2 в/в в 1 (2)й день + гидратация – изотонический раствор натрия хлорида** (≈ 2,5л), с целью поддержания диуреза > 100 мл/ч в процессе введения цисплатина** и в последующие 3 ч [224].
Цикл повторяют каждые 4 нед.
#гемцитабин** – 1000 мг/м2 в/в в 1-й и 8-й дни
карбоплатин** – AUC-4-5 в 1-й день (дозовый режим может быть изменен в зависимости от клинической ситуации – вынужденная редукция или эскалация дозы в пределах AUC-3-6)
Цикл повторяют каждые 3 нед [241].
#винбластин** – 3 мг/м2 в/в во 2-й, 15-й, 22-й дни
доксорубицин** – 30 мг/м2 в/в во 2-й день
метотрексат** – 30 мг/м2 в/в в 1-й, 15-й, 22-й дни
цисплатин** – 70 мг/м2 во 2-й день + гидратация
Цикл повторяют каждые 4 нед [239].
#винбластин** – 3 мг/м2 в/в во 2-й,
доксорубицин** – 30 мг/м2 в/в во 2-й день
метотрексат** – 30 мг/м2 в/в в 1-й,
#цисплатин** – 70 мг/м2 во 2-й день + гидратация
рчГ-КСФ
Цикл повторяют каждые 2 нед [293].
#винбластин** – 4 мг/м2 в/в в 1-й, 8-й дни,
метотрексат** – 30 мг/м2 в/в в 1-й, 8-й дни
цисплатин** – 100 мг/м2 во 2-й день + гидратация
кальция фолинат** 15 мг в/в каждые 6 ч №4 во 2-й и 9-й дни
Цикл повторяют каждые 4 нед. [339]
Оценка эффективности химиотерапии проводится на основании критериев ответа солидных опухолей на лечение (RECIST 1.1.). Оценка эффективности иммунотерапии проводится на основании критериев ответа солидных опухолей на лечение (iRECIST 1.1.). [приложение Г3].
Последовательность самостоятельной системной терапии первой и второй линий представлены в таблицах на стр. 116-117 [приложение Б].
Применение только хирургического лечения обеспечивает 5-летнюю выживаемость лишь у 50% пациентов МИ РМП [191, 220, 221]. С целью улучшения этих результатов более 30 лет применяется неоадъювантная платиносодержащая химиотерапия [222]. Несмотря на столь длительный период использования этого режима терапии, увеличение выживаемости не превышает 8% [223].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: терапию проводят перед хирургическим или лучевым лечением. Главное преимущество неоадъювантной ХТ – возможность оценить ее воздействие на первичный очаг, что может влиять на тактику дальнейшего лечения [145].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: при использовании цисплатин**-содержащих схем, по разным данным, эффект был достигнут у 40-70% пациентов. По результатам рандомизированных исследований продемонстрировано статистически значимое увеличение общей выживаемости на 5–8 % среди получавших неоадъювантную ХТ [223-228].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
В настоящее время продолжается дискуссия о целесообразности проведения адъювантной ПХТ у пациентов с высоким риском рецидива заболевания после радикальной (R0) [229]. Некоторые авторы считают, что адъювантная ХТ позволяет улучшить отдаленные результаты лечения в данной группе пациентов в среднем на 20-30%. Однако вопрос о целесообразности адъювантного лечения, оптимальном режиме химиотерапии и о сроках ее проведения остается предметом клинических исследований. В настоящее время адъювантная ХТ по схемам: GC, MVAC или MCV, может быть рекомендована пациентам с рТ2–4N0/+М0R0, не получивших неоадъювантной ХТ [230-232].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: проводились рандомизированные исследования с применением различных схем адъювантной ХТ; в большинстве из них были получены данные о продлении безрецидивного периода по сравнению с контрольной группой (только радикальная ЦЭ) [233-235].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: по данным рандомизированного исследования III фазы CheckMate 274 (включившем 709 радикально оперированных больных уротелиальным раком группы высокого риска прогрессирования (T2-4 и/или N+)) адъювантная иммунотерапия #ниволумабом** достоверно увеличивает безрецидивную выживаемость, выживаемость без рецидива за пределами мочевыводящих путей, а также выживаемость без прогрессирования независимо от статуса PD-L1 и проведения неоадъювантной химиотерапии. Адъювантная иммунотерапия ассоциирована с благоприятным профилем безопасности и не ухудшает качество жизни пациентов [304].
Первая линия лекарственной терапии
Выбор метода лекарственной терапии осуществляется на основании наличия противопоказаний к назначению цисплатина**, противопоказаний к назначению карбоплатина** и экспрессии PD-L1 в опухолевой ткани.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: противопоказанием к назначению цисплатина** является наличие не менее одного из следующих критериев: соматический статус по классификации Eastern Cooperatve Oncology Group (ECOG) > 1; скорость клубочковой фильтрации (СКФ) ≤ 60 мл/мин/1,73 м2; снижение слуха ≥ 2 степени; периферическая нейропатия ≥ 2 степени или сердечная недостаточность класса III по классификации Нью-Йоркской кардиологической ассоциации [240].
В рандомизированном исследовании III фазы (n 405) больные уротелиальным раком IV стадии, не получавшие предшествующей терапии, были рандомизированы на ХТ по схеме GC или M-VAC. Режимы продемонстрировали сопоставимые частоту объективного ответа, время до прогрессирования и 18-месячную общую выживаемость. Наиболее значимыми видами токсичности являлись миелотоксичность, сепсис на фоне фебрильной нейтропении и мукозит. У больных, получавших GC, чаще отмечались тяжелая анемия и тромбоцитопения; в группе, получавшей M-VAC, чаще регистрировались тяжелая, фебрильная нейтропения, а также тяжелые мукозиты [234].
Крупное рандомизированное исследование фазы III сравнивало DD-MVAC с поддерживающей терапией гранулоцитарными колониестимулирующими факторами со стандартным MVAC. DD-MVAC увеличивал частоту объективного ответа, однако не приводил к значимому увеличению медианы общей выживаемости. У пациентов, получавших DD-MVAC c гранулоцитарными колониестимулирующими факторами, наблюдалась меньшая общая токсичность [239].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: основанием для регистрации ингибиторов PD-(L)1 для первой линии терапии распространенного уротелиального рака у пациентов с противопоказаниями к цисплатину**, послужили исследования II фазы, в которых применялось PD-L1 тестирование опухолевой ткани. В исследовании пембролизумаба** использовалась комбинированная шкала оценки экспрессии PD-L1 (CPS), учитывающая позитивные клетки опухоли и клетки иммунной системы, инфильтрирующие опухоль [299]; в исследовании атезолизумаба** учитывалось окрашивание только иммунных клеток [244]. Результаты применения данных препаратов при оценке экспрессии по иным шкалам не изучались. В связи с этим, для селекции кандидатов для иммунотерапии пембролизумабом** и атезолизумабом** необходимо тестирование с использованием шкал с доказанной предикторной ценностью.
– при гиперэкспрессии PD-L1 ≥10% – монотерапии пембролизумабом** (200 мг в виде в/в инфузии в течение 30 минут каждые 3 недели или 400 мг 1 раз в 6 недель) [299, 304, 336];
– при гиперэкспрессии PD-L1 ≥5% – монотерапии атезолизумабом** (840 мг в виде в/в инфузии каждые 2 недели, или 1200 мг в виде в/в инфузии каждые 3 недели, или 1680 мг в виде в/в инфузии каждые 4 недели) [244, 305, 337].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: эффективность и безопасность пембролизумаба** в первой линии терапии распространенного уротелиального рака изучались в рамках многоцентрового исследования II фазы KEYNOTE-052, включившего 374 больных, имевших противопоказания к терапии цисплатином**. Первичной целью являлась частота объективного ответа у всех пациентов и у больных с гиперэкспрессией PD-L1. Оценка PD-L1-статуса проводилась по CPS. Пограничное значение экспрессии PD-L1 было выделено у первых 100 больных и составило 10%. Частота объективного ответа у всех больных составила 24%, у пациентов с экспрессией PD-L1 ≥10% – 38%. Медиана времени до ответа равнялась 2 месяца, при медиане наблюдения 5 месяцев 83% ответов продолжались, медиана длительности ответа не достигнута. Наиболее распространенными нежелательными явлениями 3-4 степени тяжести, связанными с лечением, являлись слабость (2%), повышение уровня сывороточной щелочной фосфатазы (1%) и снижение мышечной силы (1%) [299].
Ингибитор PD-L1 атезолизумаб** в первой линии терапии распространенного уротелиального рака у больных с противопоказаниями к терапии цисплатином** изучался в 1 когорте исследования IMvigor210. Статус экспрессии PD-L1 на инфильтрирующих лимфоцитах в микроокружении опухоли определяли как процент позитивных иммунных клеток: IC0 (<1%), IC1 (≥1% но <5%) и IC2/3 (≥5%). Первичной целью являлась частота объективного ответа, которая составила 23% у всех пациентов и достигла 28% у больных с гиперэкспрессией PD-L1 IC2/3. При медиане наблюдения 17,2 мес медиана длительности ответа не достигнута. Нежелательные явление, связанные с лечением, наблюдались у 66% (3-4 степени тяжести – у 16%) больных [244].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: рандомизированное исследование II/III фазы EORTC 30986 сравнивало две схемы, содержащие карбоплатин** (метотрексат**, карбоплатин**, винбластин** (M-CAVI) и GemCarbo, у пациентов с такими противопоказаниями к цисплатину**, как СКФ <60 мл/мин/1,73 м2 и/или соматический статус ECOG 2. Оба режима продемонстрировали противоопухолевую активность: частота объективного ответа составила 42% для GemCarbo и 30% для M-CAVI. Частота тяжелых нежелательных явлений достигла 13,6% и 23% в группах исследования, соответственно [241]. На основании этих данных комбинация GemCarbo стала стандартом лечения этой группы пациентов.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: рандомизированное клиническое исследование III фазы JAVELIN Bladder 100 изучало влияние поддерживающей терапии ингибитором PD-L1 авелумабом** после первой линии лечения комбинацией препарата платины и гемцитабина** у больных распространенным уротелиальным раком с объективным ответом или стабилизацией опухолевого процесса после 4–6 циклов химиотерапии. Больных рандомизировали в группу авелумаба** или наилучшей поддерживающей терапии. Авелумаб** значимо увеличивал общую выживаемость с 14,3 до 21,4 месяца (HR: 0,69; 95% СI: 0,56–0,86; p <0,001). Нежелательные явления ≥3 степени тяжести наблюдались у 47% больных группы авелумаба** по сравнению с 25% пациентов группы контроля. Иммуно-опосредованные нежелательные явления отмечены в 29% случаев, достигли ≥3 степени тяжести у 7% больных и включали колит, пневмонит, сыпь, повышение уровня печеночных ферментов, гипергликемию, миозит и гипотиреоз [301, 302].
– пациентам без противопоказаний к цисплатину**:
Цикл повторяют каждые 3нед.
– пациентам с противопоказаниями к цисплатину**:
Цикл повторяют каждые 3 нед
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: рандомизированное исследование IMvigor130 сравнивало комбинацию ингибитора PD-L1 атезолизумаба** с ХТ в режимах GC/GemCarbo с ХТ GC/GemCarbo в сочетании с плацебо или монотерапией атезолизумабом**. В исследовании была достигнута первичная конечная точка: иммуно-химиотерапия обеспечивала преимущество беспрогрессивной выживаемости по сравнению с химиотерапией и плацебо во всей популяции больных (8,2 и 6,3 месяца, соответственно; HR: 0,82 (95% CI: 0,70–0,96); p = 0,007). Незрелые данные по ОВ при медиане наблюдения 11,8 месяца не продемонстрировали различий между группами. Из-за иерархического дизайна тестирования сравнение ХТ с монотерапией атезолизумабом** еще не проводилось [300].
– монотерапии пембролизумабом** (200 мг в виде в/в инфузии в течение 30 минут каждые 3 недели или 400 мг 1 раз в 6 недель) [299, 304, 337];
– монотерапии атезолизумабом** (840 мг в виде в/в инфузии каждые 2 недели, или 1200 мг в виде в/в инфузии каждые 3 недели, или 1680 мг в виде в/в инфузии каждые 4 недели) [244, 305].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: эффективность и безопасность #пембролизумаба** в первой линии терапии распространенного уротелиального рака изучались в рамках многоцентрового исследования II фазы KEYNOTE-052, включившего 374 больных, имевших противопоказания к терапии цисплатином**. Частота объективного ответа у всех больных составила 24%, у пациентов с экспрессией PD-L1 ≥10% – 38%. Медиана времени до ответа равнялась 2 месяца, при медиане наблюдения 5 месяцев 83% ответов продолжались, медиана длительности ответа не достигнута. Наиболее распространенными нежелательными явлениями 3-4 степени тяжести, связанными с лечением, являлись слабость (2%), повышение уровня сывороточной щелочной фосфатазы (1%) и снижение мышечной силы (1%) [299].
Ингибитор PD-L1 атезолизумаб** в первой линии терапии распространенного уротелиального рака у больных с противопоказаниями к терапии цисплатином** изучался в 1 когорте исследования IMvigor210. Первичной целью являлась частота объективного ответа, которая составила 23% у всех пациентов. При медиане наблюдения 17,2 мес медиана длительности ответа не достигнута. Нежелательные явление, связанные с лечением, наблюдались у 66% (3-4 степени тяжести – у 16%) больных [244].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: формально противопоказанием к применению карбоплатина** является выраженное снижение функции костного мозга. Однако в клинической практике у больных распространенным уротелиальным раком в качестве факторов, исключающих возможность назначения карбоплатина**, используются критерии, заимствованные из рандомизированного исследования EORTC 30986 (низкий соматический статус ECOG >2, СКФ <30 мл/мин/1,73 м2 или комбинация соматического статуса ECOG 2 и СКФ <60 мл/мин/1,73 м2), так как прогноз этой популяции пациентов плохой независимо от проведения ХТ на основе препаратов платины или без них [241]. Данные о возможностях лекарственного противоопухолевого лечения у данной группы пациентов ограничены отдельными однорукавными исследованиями, показавшими приемлемую эффективность и безопасность монотерапии таксанами [306, 307] и гемцитабином** [324-328]. Имеющейся доказательной базы недостаточно для формирования клинических рекомендаций.
Вторая линия лекарственной терапии
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: рандомизированное исследование III фазы KEYNOTE-045 было направлено на сравнение эффективности пембролизумаба** и традиционной химиотерапии у больных неоперабельным местно-распространенным и диссеминированным уротелиальным раком, прогрессирующим на фоне или в течение 12 месяцев после завершения ХТ, основанной на цисплатине**. В исследование было включено 542 пациента, рандомизированного на терапию пембролизумабом** или монохимиотерапию (паклитаксел**, доцетаксел** или винфлунин). Первичной целью являлась оценка общей и беспрогрессивной выживаемости во всей популяции исследования и у больных с экспрессией PD-L1 ≥10% по CPS. При медиане наблюдения 18,5 месяца пембролизумаб** значимо увеличивал медиану общей выживаемости с 7,4 до 10,3 месяца (HR 0,70; 95% CI:0,57-0,86; p = 0,0004). Различия беспрогрессивной выживаемости между группами были недостоверны (медиана – 2,1 в группе пембролизумаба** vs 3,3 месяца в группе химиотерапии, 18-месячная – 16,8% vs 3,5% соответственно; р=0,32). Частота объективного ответа и полного ответа в группе пембролизумаба** составила 21,1% и 7,8%, в группе химиотерапии – 11,0% и 2,9% соответственно. Медиана длительности ответа на фоне терапии пембролизумабом** не достигнута, на фоне химиотерапии – 4,4 месяца. Наличие экспрессии PD-L1 (CPS≥10%) не оказывало влияния на частоту объективного ответа и показатели выживаемости. Иммунотерапия лучше переносилась пациентами: любые нежелательные явления, связанные с лечением, зарегистрированы у 61,3% больных в группе пембролизумаба** и у 90,2% пациентов, получавших химиотерапию; токсичность ≥ 3 степени тяжести зарегистрирована у 16,5% и 49,8% больных соответственно [257].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: ниволумаб** был изучен в качестве монотерапии при диссеминированном уротелиальном раке в исследовании I/II фазы CheckMate 032 у пациентов, получавших не менее 1 предшествующей линии лечения, включавшего препараты платины, независимо от статуса PD-L1. Первичной целью исследования являлась частота объективного ответа, которая составила 24,4% и не зависела от уровня экспрессии PD-L1. Связанные с лечением нежелательные явления 3-4 степени тяжести развились у 22% пациентов; наиболее частыми из них были повышение сывороточной липазы (5%) и амилазы (4%) [308].
В исследовании II фазы Checkmate 275 (n 270) ниволумаб** во второй линии терапии резистентного к препаратам платины уротелиального рака позволил добиться объективного ответа в 19,6% случаев при медиане времени до лечебного эффекта 1,9 мес. Частота объективного ответа нарастала по мере увеличения уровня экспрессии PD-L1 и составила 28,4% при положительном окрашивании ≥5% клеток, и 16,1% у пациентов с экспрессией PD-L1 <5%. Медиана беспрогрессивной выживаемости составила 2 месяца (1,87 месяца – при экспрессии PD-L1 <1% и 3,6 месяца – ≥1%). Медиана общей выживаемости равнялась 8,74 месяца у всех больных (5,95 месяца – при экспрессии PD-L1 <1% и 11,3 месяца – при экспрессии PD-L1 ≥1%). НЯ 3-4 степени тяжести, связанные с лечением, имели место в 18% наблюдений [246].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: терапия атезолизумабом** при резистентных опухолях изучалась во 2 когорте исследования IMvigor 210, включившей 315 больных распространенным уротелиальным раком, ранее получавших препараты платины. Первичной целью исследования являлась оценка частота объективного ответа, которая составила 16% у всех больных и достигла 28% при PD-L1 IC2/3 [310].
IMvigor211 – рандомизированное исследование III фазы, сравнивавшее эффективность и безопасность атезолизумаба** и ХТ (винфлунин, паклитаксел** или доцетаксел**) у пациентов диссеминированным уротелиальным раком, в течение или после как минимум одного цитотоксического режима терапии, основанного на препаратах платины (n 931). Исследование было отрицательным: достоверных различий общей выживаемости всей популяции пациентов, получавших атезолизумаб** или химиотерапию, не выявлено (медиана – 8,6 vs. 8,0 месяца соответственно, HR 0,85; 95% CI: 0,73 – 0,99) [301,309].
В исследовании IIIb фазы SAUL эффективность и безопасность атезолизумаба** изучались у 1004 пациентов резистентным местно-распространенным или метастатическим уротелиальным или неуротелиальным раком мочевыводящих путей, включая больных, не соответствующих рутинным критериям включения в клинические исследования, в том числе – пациентов, получавших химиотерапию, основанную не на препаратах платины. Медиана общей выживаемости составила 8,7 месяца, медиана беспрогрессивной выживаемости – 2,2 месяца, частота объективного ответа – 13%. Нежелательные явления ≥3 степени зарегистрированы у 45% пациентов, что привело к прекращению лечения из-за токсичности в 8% случаев [311].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: в рандомизированное исследование III фазы, сравнивавшее винфлунин с наилучшей поддерживающей терапией при распространенном уротелиальном раке у больных с прогрессированием после проведения химиотерапии, основанной на цисплатине**, вошло 370 больных. Винфлунин продемонстрировал недостоверное преимущество общей выживаемости во всей популяции пациентов по сравнению с поддерживающим лечением (6,9 vs. 4,6 месяца соответственно, HR 0,88; 95% CI, 0,69-1,12: P = 0,287). Однако при анализе фактических лечебных групп разница результатов в пользу винфлунина оказалась статистически значимой в отношении общей выживаемости (6,9 vs. 4,3 соответственно, P = 0,04), а также частоты объективного ответа (16% vs 0%, P = 0,0063), контроля над болезнью (41,1% vs 24,8%, P = 0,0024) и медианы БПВ (3,0 vs 1,5 месяца, P = 0,0012). Длительность объективного ответа на терапию винфлунином составила 7,4 месяца (95% CI 4,5 – 17,0 месяца) [242].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: IMvigor211 – рандомизированное исследование III фазы, сравнивавшее эффективность и безопасность атезолизумаба** и ХТ (винфлунин, паклитаксел** или доцетаксел**) у пациентов диссеминированным уротелиальным раком, в течение или после как минимум одного цитотоксического режима терапии, основанного на препаратах платины (n 931). Монохимиотерапия не уступала иммунотерапии в отношении общей выживаемости у всей популяции пациентов (медиана – 8,6 vs. 8,0 месяца соответственно, HR 0,85; 95% CI: 0,73 – 0,99) [301,309].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: активность #гемцитабина** при распространенном РМП была продемонстрирован в ходе испытания I фазы, в котором четыре (27%) из 15 пациентов, ранее получавших M-VAC, ответили на лечение. Дозы гемцитабина варьировали от 875 мг/м2 до 1307 мг/м2 в 1, 8 и 15 дни 28-дневного цикла [325]. Три последующие исследования фазы II с использованием #гемцитабина** в дозе 1200 мг/м2 в 1, 8 и 15 дни 4-недельного цикла продемонстрировали частоту ответов в диапазоне от 23% до 28% [326-328].
Воздействию лучевой терапии подлежат переходно-клеточные и плоскоклеточные опухоли. Не показано проведение ЛТ при НМИ РМП. Лучевую терапию по радикальной программе применяют при тотальном поражении стенок мочевого пузыря. При НМИ РМП дистанционную ЛТ применяют с органосохраняющей целью при быстро рецидивирующих или обширных опухолях, при которых невозможна ТУР; при высоком риске прогрессии. Описаны положительные результаты применения ЛТ у пациентов с неудачами БЦЖ-терапии. В целом ЛТ при НМИ РМП применяют редко, рандомизированных сравнительных исследований с другими методами лечения нет.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: лучевой терапии могут быть подвергнуты пациенты с нормальной функцией мочевого пузыря и достаточной его емкостью при отсутствии ИМТ (режим дозирования указан ниже по тексту) [260].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: несмотря на рекомендацию, в большинстве случаев проводят дистанционную ЛТ.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: лучевая терапия по радикальной программе проводится в режиме фракционирования с разовой очаговой дозой (РОД) 2 Гр, 5 раз в неделю до суммарной очаговой дозы (СОД) 60-66 Гр непрерывным курсом. При этом, как правило, вначале в объем облучения включается весь таз (мочевой пузырь и зоны регионарного метастазирования) до СОД 44-46 Гр, затем МП и паравезикальная клетчатка 14-16 Гр (до СОД 60 Гр), затем – локально опухоль МП 6 Гр (до СОД 66 Гр). При Т2N0M0 в совокупности с G1-2 возможно проведение радиотерапии без включения в объем облучения на 1 этапе регионарных ЛУ. При наличии протонного комплекса целесообразно использовать энергию протонного пучка 70-250 МэВ. По данным разных авторов, 5-летняя выживаемость колеблется в пределах 24-46%. При стадии Т2 5-летняя выживаемость составляет 25,3-59,0%, при стадии Т3 – 9-38% и при стадии Т4 – 0-16 %. Ответ на проведенное лечение наблюдается у 35-70% пациентов. Частота развития местных рецидивов составляет около 50%. Осложнения возникают у 15% пациентов; наиболее распространенные – цистит, гематурия, дизурические явления, проктит, диарея. Более чем у 2/3 мужчин развивается эректильная дисфункция.
Возможно проведение эскалации дозы на метастатически пораженные регионарные лимфатические узлы таза (при условии соблюдения границ толерантности со стороны здоровых тканей и органов).
При наличии технических возможностей, компетенции специалистов и клинического опыта возможно рассматривать вопрос проведения режима умеренного гипофракционирования до суммарной очаговой дозы 55 Гр за 20 сеансов [321].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: в ряде проведенных исследований показано снижение числа местных рецидивов после предоперационной ЛТ, однако в других исследованиях не отмечено ее влияния на выживаемость и частоту местного рецидивирования.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: дистанционная радиотерапия проводится на область ложа удаленной опухоли в РОД 2 Гр, 5 раз в неделю до СОД 50 Гр, затем локально на остаточную опухоль РОД 2 Гр, 5 раз в неделю, СОД 10-16 Гр (СОД за оба этапа составит 60-66 Гр). При наличии метастатического поражения регионарных ЛУ на первом этапе ЛТ в объем облучения включаются регионарные лимфатические узлы мочевого пузыря, РОД 2 Гр, 5 раз в неделю, СОД 50 Гр, затем локально, определяемые по данным КТ метастатические лимфатические узлы РОД 2 Гр, 5 раз в неделю, СОД 16 Гр (СОД за оба этапа составит 66 Гр). В связи с изменением топографо-анатомических соотношений после удаления МП отмечают увеличение постлучевых осложнений, особенно со стороны желудочно-кишечного тракта.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарии: в рандомизированном клиническом исследовании, а также в нескольких сериях наблюдений было продемонстрировано симптоматическое улучшение после провденеия паллиативной лучевой терапии у пациентов с симптомами РМП [329-331]. В многоцентровом рандомизированном исследовании ВА09 (n 500), сравнивавшем эффективность и безопасность двух режимов паллиативной лучевой терапии (35Гр в 10 фракциях и 21 Гр в 3 фракциях), проводившейся для достижения симптоматического улучшения у пациентов с противопоказаниями к другим видам лечения РМП, не было выявлено значимых различий частоты снижения интенсивности проявлений заболевания в лечебных группах (71% – в группе 35Гр и 64% – в группе 21Гр) и доли пациентов с зарегистрированными нежелательными явлениями; общая выживаемость в группах исследования также не различалась (HR 0,99, 95% CI 0,82-1,21, p 0,933) [331]. Основываясь на имеющихся данных, можно рекомендовать применение нескольких режимов облучения с РОД 3-8 Гр до СОД 8-35 Гр. Допустима реализация режимов экстремального гипофракционирования, применяющихся при IG-IMRT (SBRT) и предусматривающих подведение РОД ≥7 Гр за несколько фракций, для достижения лучшего анальгезирующего эффекта [322]. Данный режим радиотерапии возможен только в специализированных центрах, обладающих соответствующим уровнем технического оснащения, подготовленным персоналом и клиническим опытом выполнения данной технологии.
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с РМП при наличии хронического болевого синдрома соответствуют принципам обезболивания, изложенным в методических рекомендациях «Практические рекомендации по лечению хронического болевого синдрома у онкологических больных» (Коллектив авторов: Когония Л.М., Волошин А.Г., Новиков Г.А., Сидоров А.В., DOI:10.18 027 / 2224–5057–2018–8–3s2–617–635,https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-47.pdf).
Принципы профилактики и лечения анемии у пациентов с РМП соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях», размещенным в рубрикаторе клинических рекомендаций Минздрава России https://cr.minzdrav.gov.ru.
Принципы лечения и профилактики тошноты и рвоты у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (Коллектив авторов: Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю., DOI: 10.18 027/2224–5057–2018–8–3s2–502–511, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-35.pdf).
Принципы лечения и профилактики костных осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (Коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., Семиглазова Т.Ю., DOI: 10.18 027/2224–5057–2018–8–3s2–512–520, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (Коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М., DOI: 10.18 027 / 2224–5057–2018–8–3s2–521–530, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (Коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В., DOI: 10.18 027/2224–5057–2018–8–3s2–531–544, https://rosoncoweb.ru/standarts/RUSSCO/
2018/2018-38.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (Коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А., DOI: 10.18 027/2224–5057–2018–8–3s2–545–563, https://rosoncoweb.ru/standarts/RUSSCO/
2018/2018-39.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (Коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В., DOI: 10.18 027/2224–5057–2018–8–3s2–564–574, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf).
Принципы нутритивной поддержки у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (Коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж., DOI: 10.18 027/2224–5057–2018–8–3s2–575–583, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (Коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А., DOI: 10.18 027/2224–5057–2018–8–3s2–591–603, https://rosoncoweb.ru/standarts/RUSSCO/2018/
2018-44.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (Коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10.18 027/2224–5057–2018–8–3s2–604–609, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-45.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазациипротивоопухолевых препаратов» (Автор: Буйденок Ю.В., DOI: 10.18 027/2224–5057–2018–8–3s2–610–616, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf).
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с РМП соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» (Коллектив авторов: Проценко С.А., Антимоник Н.Ю., Берштейн Л.М., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Чубенко В.А., Юдин Д.И., DOI: 10.18 027/2224–5057–2018–8–3s2–636–665, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-48.pdf).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Предположение о том, что сахарин является канцерогеном и вызывает РМП, основанное на экспериментальных результатах, не было подтверждено эпидемиологическими исследованиями. По данным американских исследователей, заболеваемость РМП в 1,5–2 раза выше в населенных пунктах, жители которых в течение длительного времени (40–60 лет) употребляли хлорированную воду из поверхностных источников. Роль питания в этиологии РМП остается неясной, несмотря на достаточно большое количество эпидемиологических исследований, посвященных этой проблеме.
Предреабилитация проводится всем пациентам с МИ РМП, включает физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций –А (уровень достоверности доказательств – 3).
Комментарии: психологическая поддержка в плане предреабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической предреабилитации, лучше адаптируются к повседневной жизни после хирургического лечения.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: тактика fast-track rehabilitation («быстрый путь») и ERAS (early rehabilitation after surgery – ранняя реабилитация после операции), включающая в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, ранняя мобилизация (активизация и вертикализация) пациентов уже с 1–2 суток после операции не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций, а улучшает функциональные возможности в раннем послеоперационном периоде. Данная методика эффективна и безопасна у пациентов урологического профиля. Методика fast-track rehabilitation безопасна и эффективна у пациентов и после радикальной ЦЭ.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
Лечение болевого синдрома в послеоперационном периоде носит междисциплинарный характер и помимо медикаментозной коррекции включает в себя физическую реабилитацию (ЛФК), лечение положением, психологические методы коррекции боли (релаксация), чрескожную электростимуляцию, акупунктуру.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Уровень убедительности рекомендаций – A (уровень достоверности доказательств –3).
Комментарии: проводятся занятий ЛФК средней интенсивности по 15-30 минут в день 3–5 раз в неделю, постепенно увеличивая длительность. Сочетаются аэробные нагрузки длительностью 150 минут в неделю и силовые – 2 раза в неделю.
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 3).
Комментарии: Упражнения на тренировку баланса более эффективны для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Профилактика заболевания отсутствует.
Диспансерному наблюдению подлежат взрослые с онкологическими заболеваниями, включенными в рубрики С00-D09 МКБ-10.
Диспансерное наблюдение организуется в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете медицинской организации, онкологическом диспансере (онкологической больнице) или иных медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями.
Комментарии: в соответствии с приказом Министерства здравоохранения Российской Федерации от 04 июня 2020 г. № 548н «Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями» для пациентов с НМИ РМП устанавливается группа диспансерного наблюдения (2-ДН-онко). Категория наблюдаемых пациентов – лица с подтвержденным диагнозом ЗНО. Рекомендуемая периодичность диспансерных приемов пациента врачом (в течение первого года-1 раз в 3 месяца, в течение второго года-1 раз в 6 месяцев, в дальейшем-1 раз в год (если течение заболевания не требует изменения тактики ведения больного).
При органосохраняющем лечении у пациентов с НМИ РМП (группа низкого и промежуточного риска):
− Цистоскопия и микроскопическое исследование осадка мочи раз в 3 мес. в течение 2 лет, далее каждые 6 мес., далее ежегодно [279-281]
При органосохраняющем лечении у пациентов с НМИ РМП (группа высокого и высочайшего риска) и пациентов с МИ РМП:
− Цистоскопия и микроскопическое исследование осадка мочи раз в 3 мес. в течение 2 лет, далее каждые 6 мес., далее ежегодно [279-281]
− КТ брюшной полостей и малого таза с контрастированием (методика КТ-урографии) 1 раз в 6 мес. в течении года, далее – через 1 год – каждые 12 мес. При выявлении признаков рецидивирования требуется расширение объема исследования – КТ грудной полости [283]. При противопоказаниях к контрастированию йодсодержащими контрастными препаратами (V08A: Рентгеноконтрастные средства, содержащие йод) КТ брюшной полости и малого таза с контрастированием целесообразно заменить на МРТ брюшной полости и малого таза. При этом следует индивидуально оценивать необходимость и безопасность контрастирования при МРТ. Кроме того, при выявлении признаков рецидивирования РМП целесообразно добавить в объем исследования КТ грудной полости без контрастирования;
После радикальной ЦЭ:
– МРТ брюшной полости и малого таза (по рекомендациям VI-RADS) с контрастированием, КТ грудной полости без контрастирования или как альтернатива – КТ грудной, брюшной полостей и малого таза с контрастированием (методика КТ-урографии) 1 раз в 6 мес., через 1 год – каждые 12 мес. [283]; при противопоказаниях к контрастированию йодсодержащими контрастными препаратами целесообразно выполнить МРТ брюшной полости и малого таза (по рекомендациям VI-RADS) и КТ грудной полости без контрастирования [284]. При этом следует индивидуально оценивать необходимость и безопасность контрастирования при МРТ.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: проводится цистоскопия через 3 мес. пациентам с опухолями ТаT1. Если результат отрицательный, последующую цистоскопию рекомендуется проводить через 9 мес., а затем –ежегодно в течение 5 лет
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Если результат отрицательный, последующие цистоскопию и цитологию необходимо повторять каждые 3 мес. на протяжении 2 лет и далее каждые 6 мес. до 5 лет, а затем – 1 раз в год [286].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи, а при отсутствии в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 3 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет) биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней со дня назначения исследований.
Диагноз онкологического заболевания устанавливается врачом-специалистом на основе результатов диагностических исследований, включающих в том числе проведение цитологической и (или) гистологической верификации диагноза, за исключением случаев, когда взятие биопсийного и (или) пункционного материала не представляется возможным.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения. В случае подтверждения у пациента наличия онкологического заболевания информация об уточненном диагнозе направляется из онкологического диспансера или организации субъекта Российской Федерации, исполняющей функции регистрации пациентов с впервые выявленном злокачественным новообразованием, в медицинскую организацию, осуществляющую диспансерное наблюдение пациента
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи. (Пункт 5: для получения специализированной медицинской помощи в плановой форме выбор федеральной медицинской организации осуществляется по направлению лечащего врача.) В случае если в реализации Программы принимают участие несколько федеральных медицинских организаций, оказывающих специализированную медицинскую помощь при заболеваниях, состояниях (группе заболеваний, состояний), соответствующих заболеваниям, состояниям (группе заболеваний, состояний) пациента, лечащий врач обязан проинформировать пациента (законного представителя пациента) о возможности выбора федеральной медицинской организации, в том числе о возможных сроках ожидания специализированной медицинской помощи, которые могут превышать сроки ожидания, установленные программой государственных гарантий бесплатного оказания гражданам медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения онкологического заболевания (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.), требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, а также проведение эндоскопических исследований при невозможности выполнить их амбулаторно, требуют последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Наиболее значимые факторы для НМИ РМП, определяющие вероятность рецидива и прогрессии: количество опухолей, их размер, частота рецидивов в анамнезе, категория Т, наличие сопутствующей CIS, степень злокачественности опухоли.
Независимыми факторами, негативно влияющими на общую выживаемость при проведении химиотерапии, являются: статус по шкале Карновского <80 %, оценка по шкале ECOG≤2, (приложение Г1 и Г2) и наличие висцеральных метастазов.
К неблагоприятным прогностическим факторам при проведении 2 линии химиотерапии относят: общее состояние по шкале ECOG >1 (приложение Г1), уровень гемоглобина <10 г/дл. Другим дополнительным фактором, имеющим прогностическое значение при проведении 2 линии химиотерапии, является эффективность 1 линии терапии и время до прогрессирования болезни более 12 мес. после ее применения. Соответственно, повторное назначение химиотерапии через 12 мес. после ранее достигнутого эффекта на предыдущей линии может быть оправданной тактикой лечения пациентов с благоприятными прогностическими характеристиками.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Учитывая неоднозначные показатели чувствительности и специфичности ЦИ мочи, были предложены к использованию целый ряд маркеров мочи [65]. Однако ни один из них в настоящее время не применяется в рутинной практике и не указан в клинических рекомендациях. В табл. 2 представлены некоторые диагностические тесты мочи, результаты которых были оценены в различных клинических исследованиях с достаточным количеством пациентов [66–68].
Таблица 3. Краткая информация об основных маркерах, выявляемых в моче
| Маркеры | ОЧ, % | ОС, % | Чувствительность по отношению к опухолям T1G3, % | УД |
|---|---|---|---|---|
| FISH test | 30–86 | 63–95 | 66–70 | 3 |
| Микросателлитныйанализ | 58–92 | 73–100 | 90–92 | 1b |
| Immunocytochemical test | 52–100 | 63–75 | 62–92 | 3 |
| NMP22 | 47–100 | 55–98 | 75–83 | 3 |
| bladder tumor antigen test stat | 29–83 | 56–86 | 62–75 | 3 |
| Цитокератины | 12–88 | 73–95 | 33–100 | 3 |
ОЧ – общая чувствительность, ОС – общая специфичность
Имеющиеся данные на основании полученных результатов оценки различных тест-систем позволяют сделать следующие выводы:
Молекулярно-генетические методы исследования применяют в лабораторной диагностике рака мочевого пузыря, в основном, для решения трех практических задач: уточняющей неинвазивной диагностики рецидива НМИ РМП для снижения количества ненужных цистоскопий с биопсиями, выявления молекулярных мишеней метастатического РМП для таргетной терапии и диагностики редких наследственных форм РМП [133].
Тест-системы для неинвазивной диагностики РМП и его рецидива в моче представляют собой в большинстве случаев комбинированный тест на несколько частых мутаций РМП (FGFR3, TERT), аберрантно гиперметилированных генов, экспрессию РНК и/или белковых онкомаркеров. Эти тесты в большей мере предназначены для уточняющей диагностики при мониторинге возникновения рецидива НМИ РМП в узких когортах пациентов, для которых характерна низкая чувствительность цитологического анализа (небольшие высокодифференцированные опухоли, гематурия) [134-136, 236, 243, 245]. Однако в настоящее время в России ни одна из молекулярно-генетических тест-систем для неинвазивной диагностики РМП не зарегистрирована, и в актуальную версию ведущих зарубежных и отечественных клинических рекомендаций не входит. Аналогичное замечание касается выявления соматических мутаций FGFR3 у пациентов с местнораспространенным неоперабельным и/или метастатическим РМП при решении вопроса о назначении эрдафитиниба – препарат и тест-система для FGFR-тестирования одобрены FDA и присутствуют в рекомендациях NCCN v.5 2021, но пока не имеют регистрационных удостоверений в России [247-249, 252].
Диагностика синдрома Линча с развитием РМП. Наследственный РМП встречается в недифференцированной когорте пациентов с частотой около 0,5-1% и относится, в основном, к проявлениям синдрома Линча – наследственного онкологического синдрома, который обусловлен мутацией в одном из генов системы репарации неспаренных нуклеотидов (MMR – mismatch repair deficiency): MLH1, MSH2, MSH6, PMS1, PMS2 или EPCAM. При этом синдроме в порядке убывания по частоте встречаемости описаны колоректальный рак, эндометриоидный рак, рак яичников, рак желудка, уротелиальные карциномы различных отделов мочевыделительной системы, рак предстательной железы и некоторые другие типы опухолей. РМП чаще развивается при мутации в MSH2. На наследственный характер заболевания может указывать молодой возраст пациента, неблагоприятный семейный онкологический анамнез, первично-множественные опухоли, в анамнезе пациента – новообразования в других органах-мишенях синдрома Линча. Молекулярно-генетическая диагностика заключается в анализе микросателлитной нестабильности, высокую степень которой (статус MSI-H) рассматривают как вероятное подтверждение заболевания. Однако минимальная панель из 5 мононуклеотидных STR-маркеров, зачастую используемая при колоректальном раке, в опухолях других типов обладает недостаточной чувствительностью. В связи с этим статус MSI-H в уротелиальных карциномах следует определять с помощью ИГХ-анализа и выявления потери экспрессии одного из ключевых участников системы репарации неспаренных оснований: MLH1, MSH2, MSH6 или PMS2 [255, 258]. В случае выявления MSI-H наиболее информативным генетическим исследованием является определение герминальной мутации в генах-кандидатах синдрома Линча с помощью высокопроизводительного секвенирования (ВПС, англ. аналог – NGS, next generation sequencing) панели генов MMR. В отдельных случаях РМП может развиваться у носителей герминальных мутаций в генах BRCA1/2, MUTYH, RB1 и некоторых других. Если молодой пациент не удовлетворяет диагностическим критериям синдрома Линча, то ему может быть выполнено ВПС экзома или мультигенной онкологической панели [296-298]. Диагностику и динамическое наблюдение пациентов с наследственными онкологическими синдромами целесообразно проводить с участием врача-генетика, который проводит медико-генетическое консультирование пробанда, в также его родственников – возможных носителей патогенной мутации.
| № | Критерии качества | Оценка выполнения |
|---|---|---|
| 1. | Выполнено ультразвуковое исследование мочевого пузыря и почек | Да/Нет |
| 2. | Проведена цистоскопия | Да/Нет |
| 3. | Проведено патологоанатомическое исследование биопсийного (операционного) материала | Да/Нет |
| 4. | Выполнена магнитно-резонансная томография малого таза с контрастированием | Да/Нет |
| 5. | Выполнено хирургическое лечение пациенту с локализованным или местно-распространенным операбельным раком мочевого пузыря | Да/Нет |
| 6. | Выполнено патологоанатомическое исследование биопсийного (операционного) материала удаленных тканей | Да/Нет |
Блок по организации медицинской помощи:
Конфликт интересов:
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Целевая аудитория данных клинических рекомендаций – специалисты, имеющие высшее медицинское образование по следующим специальностям:
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Таблица 4. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематические обзоры исследований с контролем референсным методом, или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с контролем референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описания клинического случая |
| 5 | Имеются лишь обоснование механизма действия или мнение экспертов |
Таблица 5. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
| 4 | Несравнительные исследования, описания клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеются лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 6. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
|---|---|
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества; все рассматриваемые критерии эффективности (исходы) не являются важными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
Первичная и уточняющая диагностика рака мочевого пузыря
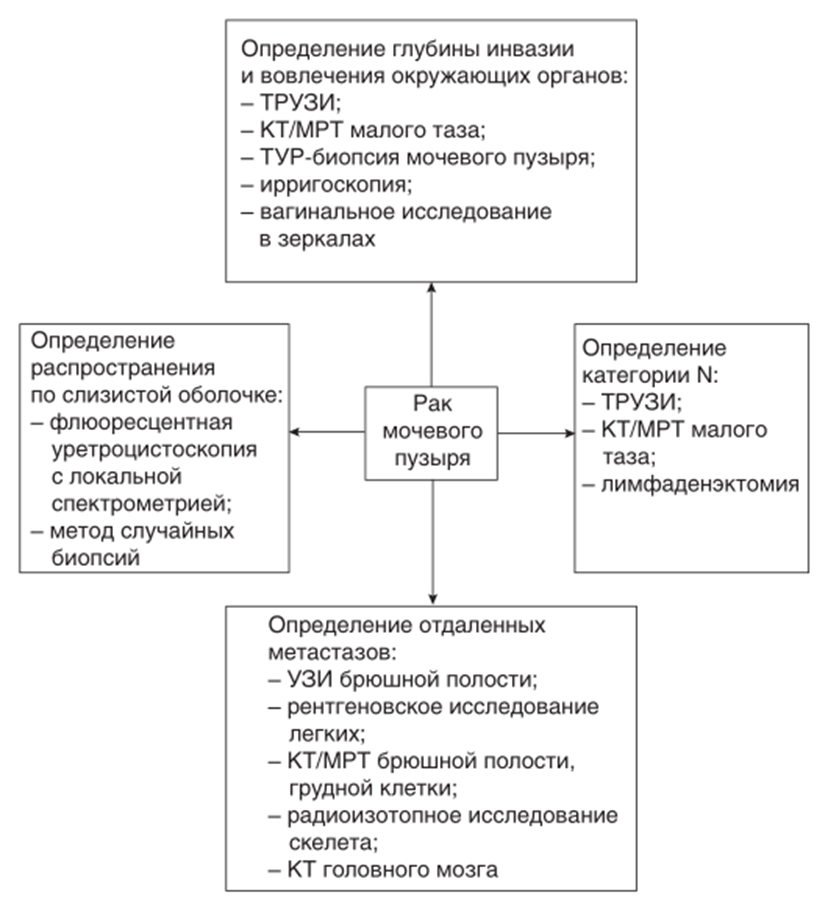
Рисунок 1. Схема первичной диагностики рака мочевого пузыря
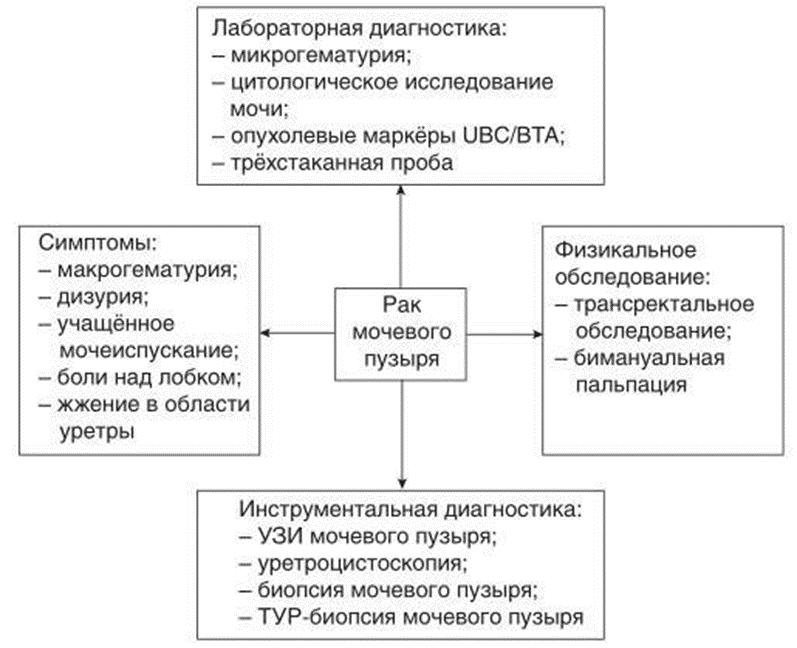
Рисунок 2. Схема уточняющей диагностики рака мочевого пузыря
Самостоятельная системная терапия
Таблица №7: Первая линия системной противоопухолевой терапии
| Группа | Режим предпочтения | Альтернативный режим |
|---|---|---|
| Нет противопоказаний к цисплатину1 | GCMVACddMVAC | GC+атезолизумаб |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L- | GarboGem | GarboGem +атезолизумаб |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L+ | GarboGem Атезолизумаб*#Пембролизумаб** | GarboGem +атезолизумаб |
| Есть противопоказания к препаратам платины | ДоцетакселПаклитакселГемцитабин | Атезолизумаб*#Пембролизумаб** |
| При контроле над опухолью после 4-6 циклов ХТ, основанной на препарате платины | Авелумаб |
1 ECOGPS> 1; CКФ ≤ 60 мл/мин/1,73 м2; снижение слуха ≥ 2 степени; периферическая нейропатия ≥ 2 степени; СН класса IIINYHA.
2 Критерии РКИ EORTC 30986 (PSECOG>2; СКФ <30 мл/мин/1,73 м2; ECOGPS 2 и СКФ <60 мл/мин/1,73 м2).
*Для атезолизумаба положительной является экспрессия ≥5% (VentanaPD-L1 (SP142) Assay® (VentanaMedicalSystems, Inc.))
**Для пембролизумаба положительной является экспрессия ≥10% (тест-система DakoPD-L1 IHC 22C3 PharmDxAssay (DakoNorthAmerica, Inc.))
| Группа | Режим предпочтения | Альтернативный режим |
|---|---|---|
| Нет противопоказаний к цисплатину1 | GCMVACddMVAC | GC + #атезолизумаб** |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L- | GarboGem | GarboGem + #атезолизумаб** |
| Есть противопоказания к цисплатину, нет противопоказаний к карбоплатину2, PD-L+ | GarboGem Атезолизумаб**3Пембролизумаб**4 | GarboGem + #атезолизумаб** |
| Есть противопоказания к препаратам платины | #Доцетаксел**#Паклитаксел**#Гемцитабин** | Атезолизумаб**Пембролизумаб** |
| При контроле над опухолью после 4-6 циклов ХТ, основанной на препарате платины | Авелумаб** | — |
1 ECOGPS> 1; CКФ ≤ 60 мл/мин/1,73 м2; снижение слуха ≥ 2 степени; периферическая нейропатия ≥ 2 степени; СН класса IIINYHA.
2 Критерии РКИ EORTC 30986 (PSECOG>2; СКФ <30 мл/мин/1,73 м2; ECOGPS 2 и СКФ <60 мл/мин/1,73 м2).
3 Для атезолизумаба положительной является экспрессия ≥5% (VentanaPD-L1 (SP142) Assay® (VentanaMedicalSystems, Inc.))
4 Для пембролизумаба положительной является экспрессия ≥10% (тест-система DakoPD-L1 IHC 22C3 PharmDxAssay (DakoNorthAmerica, Inc.))
Таблица №8: Вторая линия системной противоопухолевой терапии
| Лечение 1 линии | Режим предпочтения | Альтернативный режим |
|---|---|---|
| Химиотерапия, основанная на препаратах платины | Пембролизумаб** | Атезолизумаб**Ниволумаб**Винфлунин#Паклитаксел**#Доцетаксел** |
| Химиотерапия, основанная не на препаратах платины | Атезолизумаб** | Винфлунин |
| Иммунотерапия ингибиторами иммунных контрольных точек | Режимы химиотерапии, не использованные ранее или использованные за 12 и более месяцев до прогрессирования, с достигнутым эффектом или стабилизацией |
Пациента информируют о клинической картине РМП, знакомят с различными методами лечения, их потенциальными результатами и осложнениями.
Следует информировать пациента о симптоматике, различных осложнениях РМП. Особенно важно предупреждать пациентов с РМП с метастатическим поражением позвонков о возможной компрессии спинного мозга с целью незамедлительного обращения к врачу при возникновении данного осложнения.
Следует информировать пациента о характере последующего наблюдения после лечения РМП, о важности регулярного обследования.
Пациентов с метастатическим РМП следует информировать о проводимых в Российской Федерации клинических исследованиях у пациентов с указанной стадией заболевания.
Самостоятельный контроль за течением заболевания со стороны пациента невозможен; частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Рекомендации при осложнениях химиотерапии – связаться с врачом!
1) При повышении температуры тела 38°C и выше рекомендовано применение противомикробной терапии по рекомендации врача.
2) При стоматите:
3) При диарее:
4) При тошноте:
Принимать препараты по рекомендации врача.
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J ClinOncol 1982,5(6):649–655 [250]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа ит.д.)
Содержание (шаблон):
| Балл | Описание |
|---|---|
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели |
| 5 | Пациент мертв |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Шкала Карновского
Оригинальное название: KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Edited by MacLeod C. New York: Columbia University Press; 1949: 191–205 [251]
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа и т.д.)
Содержание (шаблон):
| Шкала Карновского |
|---|
| 100 – Состояние нормальное, жалоб нет90 – Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 – Нормальная активность с усилием, незначительные симптомы или признаки заболевания70 – Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 – Нуждается порой в помощи, но способен сам удовлетворять бóльшую часть своих потребностей50 – Нуждается в значительной помощи и медицинском обслуживании |
| 40 – Инвалид, нуждается в специальной помощи, в т.ч. медицинской30 – Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 – Тяжелый пациент. Необходимы госпитализация и активное лечение10 – Умирающий |
| 0 – Смерть |
Ключ (интерпретация): приведен в самой шкале.
Критерии оценки ответа солидных опухолей на лечение RECIST 1.1
Название на русском языке: Критерии оценки ответа солидных опухолей на лечение 1.1.
Оригинальное название (если есть): Response Evaluation Criteria In Solid Tumors 1.1 (RECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M., Rubinstein L., Shankar L., Dodd L., Kaplan R., Lacombe D., Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009;45(2):228–47. DOI: 10.1016/j.ejca.2008.10.026 [248].
Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на лечение.
Содержание (шаблон):
| Ответ на лечение | RECIST 1.1 |
|---|---|
| Полный ответ | Отсутствие всех целевых образований или лимфоузлов ≥10 мм по короткой оси |
| Частичный ответ | Уменьшение сумм наибольших диаметров целевых очагов на ≥30 % |
| Прогрессирование | Увеличение сумм наибольших диаметров целевых очагов на ≥20 % с абсолютным приростом ≥5 ммПоявление новых очагов |
| Стабилизация | Ничего из перечисленного |
Ключ (интерпретация): приведен в самой шкале.
Название на русском языке: Критерии оценки иммуноопосредованного ответа солидных опухолей.
Оригинальное название (если есть): Immune-Related Response Evaluation Criteria In Solid Tumors (iRECIST).
Источник (официальный сайт разработчиков, публикация с валидацией): Seymour L., Bogaerts J., Perrone A. et al. RECIST working group. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol 2017;18(3):e143–52. doi: 10.1016/S1470-2045(17)30074-8. Epub 2017 Mar 2 [238].
Тип: шкала оценки.
Назначение: унификация оценки ответа солидных опухолей на иммунотерапию.
Содержание (шаблон):
| Ответ на лечение | iRECIST |
|---|---|
| Полный ответ | Отсутствие всех целевых образований или лимфоузлов ≥10 мм по короткой оси |
| Частичный ответ | Уменьшение сумм наибольших диаметров целевых очагов на ≥30 % |
| Прогрессирование | Увеличение сумм наибольших диаметров целевых очагов на ≥20 % с абсолютным приростом ≥5 ммПоявление новых очагов не является признаком прогрессирования; диаметры новых очагов прибавляются к общей сумме таргетных очагов; окончательная оценка ответа опухоли требует подтверждения через 4 нед |
| Стабилизация | Ничего из перечисленного |
Ключ (интерпретация): приведен в самой шкале.