ᅠ ᅠ
Скачать в PDF ⟶
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:
C68.0
Возрастная категория:
Взрослые
Год утверждения:
2020
Год окончания действия:⠀
NaN
Статус
Действует
Рабочая группа:
Блок по организации медицинской помощи:
Конфликта интересов нет.
Разработчик клинической рекомендации:
Список сокращений
Термины и определения
в/в – внутривенно
КТ – компьютерная томография
ЛФК – лечебная физкультура
МРТ – магнитно-резонансная томография
СКФ – скорость клубочковой фильтрации
СОД – суммарная очаговая доза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся вне показаний (офф-лейбл)
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Злокачественный приапизм – болезненная патологическая эрекция, обусловленная распространением опухолевого процесса на кавернозные тела полового члена.
Операция Дюкена – пахово-бедренная лимфаденэктомия.
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Предреабилитация – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры (ЛФК), рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Рак уретры – редкое онкологическое заболевание, связанное с развитием злокачественного новообразования в тканях стенки мочеиспускательного канала [1].
Факторами риска развития рака уретры у мужчин являются стриктуры мочеиспускательного канала, хроническое раздражение слизистой, дистанционная и внутритканевая лучевая терапия, а также хронический уретрит [2–9]. Факторами риска развития рака уретры у женщин являются уретральные дивертикулы, хронические мочевые инфекции, установка уретрального слинга [10–12].
Первичный рак мочеиспускательного канала у мужчин встречается крайне редко. Опухоль встречается в любом возрасте, хотя чаще страдают мужчины старше 50 лет. У женщин рак уретры встречается несколько чаще. Его первичные формы составляют 0,02–0,5 % злокачественных новообразований женской мочеполовой сферы. Обычно опухоль развивается в периоде постменопаузы, 75 % пациентов, страдающих раком уретры, старше 50 лет [13, 14].
По Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (далее ‒ МКБ-10) рак уретры имеет код C68.0 – злокачественное новообразование уретры (мочеиспускательного канала).
Гистологическая классификация рака уретры:
Уротелиальные опухоли
Инфильтративный уротелиальный рак 8120/3
Гнездный, включая крупногнездный
Микрокистозный
Микропапиллярный 8131/3
Лимфоэпителиомоподобный 8082/3
Плазмоцитоидный/перстневидноклеточный/диффузный
Саркоматоидный 8122/3
Гигантоклеточный 8031/3
Низкодифференцированный 8020/3
Богатый липидами
Светлоклеточный
Неинвазивные уротелиальные поражения
Уротелиальная карцинома in situ 8120/2
Неинвазивный папиллярный урротелиальный рак низкой степени злокачественности 8130/3
Неинвазивный папиллярный уротелиальный рак высокой степени злокачественности 8130/2
Папиллярная уротелиальная опухоль низкого злокачественного потенциала 8130/1
Уротелиальная папиллома 8120/0
Инвертированная уротелиальная папиллома 8121/0
Уротелиальная пролиферация неизвестного злокачественного потенциала
Уротелиальная дисплазия
Плоскоклеточные опухоли
Чистый плоскоклеточный рак 8070/3
Веррукозная карцинома 8051/3
Плоскоклеточная папиллома 8052/0
Железистые опухоли
Аденокарцинома, неспецифическая 8140/3
Энтерическая 8144/3
Муцинозная 8480/3
Смешанная 8140/3
Виллезная аденома 8261/0
Урахальная карцинома 8010/3
Опухоли мюллерова типа
Светлоклеточная карцинома 8310/3
Эндометриоидная карцинома 8380/3
Гистопатологическая градация рака уретры [15]:
Гистопатологическая градация неуротелиальной карциномы уретры:
Стадирование
Стадирование рака уретры осуществляется в соответствие с классификацией TNM AJCC/UICC 8-го пересмотра [16].
Критерий T – первичная опухоль (мужчины и женщины):
Критерий N – региональные лимфатические узлы:
Критерий M – отдаленные метастазы:
рTNM патологоанатомическая классификация: категории рT, pN, pM соответствуют категориям T, N, M.
G гистопатологическая градация [9]:
Группировка по стадиям
| Стадия 0а | Ta | N0 | M0 |
| Стадия 0is | Tis | N0 | M0 |
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия III | T1 | N1 | M0 |
| T2 | N1 | M0 | |
| T3 | N0, N1 | M0 | |
| Стадия IV | T4 | N0, N1 | M0 |
| любая Т | N2 | M0 | |
| любая Т | любая N | M1 |
К ранним клиническим симптомам рака уретры у женщин относят:
На поздних стадиях появляются:
Задержка мочи у женщин, страдающих раком уретры, развивается редко, что обусловлено анатомическими особенностями женского мочеиспускательного канала.
Инфильтрация стенки уретры может привести к недержанию мочи.
При распространении опухолевого процесса на влагалище с формированием уретровагинального свища у пациентов отмечается истечение мочи из половых путей.
Возможно развитие интенсивных влагалищных кровотечений.
Клиническая картина рака мочеиспускательного канала у мужчин в начальных стадиях стерта и во многом зависит от заболевания, на фоне которого развивается злокачественный процесс. Неспецифичность симптомов приводит к поздней диагностике рака, так как его первые проявления нередко приписывают заболеваниям уретры, ведущим к развитию стриктуры. Под маской обструкции мочеиспускательного канала опухоль иногда не выявляют в течение 12–18 мес с момента первых проявлений.
Первыми симптомами рака мужской уретры являются:
На более поздних стадиях возможно появление:
Дальнейший рост опухоли, инфильтрирующей стенку уретры, может привести к задержке мочи. Возможно появление периуретральных абсцессов и свищей. При распространении опухолевого процесса на кавернозные тела полового члена в ряде случаев развивается злокачественный приапизм. Опухолевый тромбоз лимфатических сосудов таза и паховой области может привести к появлению отека мошонки, полового члена и нижних конечностей.
У 1/3 пациентов при пальпации паховых областей выявляются увеличенные лимфатические узлы. По мере роста узлы сливаются в конгломераты, становятся неподвижными и могут изъязвляться.
Появление метастазов в паренхиматозные органы вызывает развитие соответствующей симптоматики.
Критерии установления диагноза/состояния:
Клинический диагноз основан на результатах:
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: опухоли наружного отверстия мочеиспускательного канала, как правило, хорошо видны невооруженным глазом и представляют собой сóлидные объемные образования синюшно-багрового цвета, без четких границ, склонные к изъязвлению и кровоточивости.
Новообразования, расположенные проксимальнее, могут быть диагностированы пальпаторно. Необходимо тщательное обследование спонгиозного и кавернозного тел полового члена с целью выявления их вовлечения в опухолевый процесс. Влагалищное и ректальное исследования дают возможность оценить состояние парауретральных тканей, выявить инфильтрацию стенок влагалища, предстательной железы. При осмотре пациента с раком уретры следует обратить особое внимание на состояние паховых лимфатических узлов, увеличение которых, как правило, свидетельствует об их метастатическом поражении.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5)
Комментарий: морфологическое подтверждение диагноза получают при гистологическом исследовании биоптата опухоли. Возможно также цитологическое исследование мазков-отпечатков и соскобов с новообразования уретры. В тех случаях, когда опухоль располагается в проксимальном отделе мочеиспускательного канала, исследуют отделяемое из уретры. Следует учитывать, что отрицательные результаты цитологического исследования не означают отсутствия опухоли.
По данным литературы, ошибки в диагностике опухолей мочеиспускательного канала встречаются в 10 % случаев. У мужчин дифференциальный диагноз рака уретры следует проводить с доброкачественными опухолями, стриктурой уретры, гипертрофией семенного бугорка, хроническим уретритом, туберкулезом, раком предстательной железы, камнем, сифилисом уретры. Описан случай плоскоклеточного рака уретры, клинически протекавшего под маской абсцесса мошонки [2]. У женщин рак мочеиспускательного канала следует отличать от опухоли вульвы и влагалища, доброкачественных новообразований и воспалительных заболеваний уретры, парауретральных кист, а также выпадения слизистой оболочки уретры, сочетающегося с опущением стенок влагалища. Единственным достоверным критерием, позволяющим исключить рак мочеиспускательного канала, является морфологическая верификация диагноза.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: уретроцистоскопия позволяет оценить локализацию, размеры опухоли, цвет и характер ее поверхности, состояние окружающей слизистой оболочки. Для рака мочеиспускательного канала характерно наличие сóлидной опухоли на широком основании, с легко кровоточащей и нередко изъязвленной поверхностью.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: объем хирургического лечения определяется размерами опухоли и может заключаться в иссечении, электроэксцизии, лазерной вапоризации или коагуляции опухоли, циркулярной резекции мочеиспускательного канала.
Лучевая терапия при поверхностном раке дистальной уретры применяется в виде внутриполостной или внутритканевой брахитерапии с подведением к опухоли суммарной очаговой дозы (СОД) 50–65 Гр. Применение данных методик позволяет добиться хорошего местного эффекта и сохранить самостоятельное мочеиспускание.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: применяется внутриполостная/внутритканевая лучевая терапия с использованием 1 или 2 имплантов 192Ir в сочетании с наружным облучением зоны опухоли и регионарных лимфатических узлов. К опухолевому очагу подводится СОД от 70 до 85 Гр в зависимости от размеров новообразования. СОД на паховые и подвздошные области при отсутствии увеличенных лимфатических узлов составляет 50 Гр. Наличие метастазов в паховых и тазовых лимфатических узлах требует увеличения СОД до 60–65 Гр. Тяжелые осложнения облучения (кишечная непроходимость, свищи, стриктуры уретры, недержание мочи) наблюдаются у 15–40 % пациентов. Пациенткам с неполным эффектом лучевой терапии рекомендовано удаление резидуальной опухоли через 4–6 нед после завершения облучения. Объем операции может включать резекцию уретры или уретрэктомию с цистостомией.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
При отсутствии противопоказаний к назначению цисплатина:
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
CarboGem (гемцитабин** 1000 мг/м2 в/в капельно, 1-й и 8-й дни, #карбоплатин** AUC 4-5 в/в капельно, 1-ый или 2-й день (назначение на 2-ой день более безопасно для пациента), каждый 21-й день, до 4–6 циклов) [25-28].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
При отсутствии противопоказаний к назначению цисплатина:
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: возможность применения химиолучевой терапии как альтернативы хирургическому вмешательству при плоскоклеточном раке уретры доказана в нескольких сериях наблюдений [30-32]. Частота полных эффектов при использовании дистанционной лучевой терапии в сочетании с радиомодифицирующими препаратами (#митомицин** в/в болюсно, 10 мг/м2, 1, 29 дни #фторурацил** 1000 мг/м2в/в инфузия в течение 24 часов, 1-4 и 29-32 дни) составляет 80 %, 5-летняя общая и специфическая выживаемость – 52 и 68 % соответственно. При неполном эффекте химиолучевой терапии хирургическое удаление резидуальной опухоли увеличивает выживаемость [32].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: хирургическое вмешательство выполняется через 4–6 нед после окончания неоадъювантного лечения. При новообразовании, располагающемся в пределах мочеиспускательного канала (Т1), возможно выполнение уретрэктомии. Распространение опухоли на периуретеральные ткани, вагину (Т2–3) требует выполнения уретрэктомии, вульвэктомии и удаления передней стенки влагалища. При вовлечении в процесс шейки мочевого пузыря (Т3) рекомендуется уретрэктомия с резекцией шейки мочевого пузыря. При большей распространенности опухолевого процесса (Т3–4) проводят цистуретрэктомию с резекцией передней стенки влагалища.
С целью радикального удаления опухоли в ряде случаев требуется расширение объема хирургического вмешательства:
После выполнения уретрэктомии с сохранением мочевого пузыря рекомендуется наложение цистостомы. После цистуретрэктомии наиболее распространенным методом отведения мочи является операция Брикера. У ослабленных пациентов с целью уменьшения продолжительности и травматичности хирургического вмешательства возможно наложение уретерокутанеостом.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: в настоящее время остается открытым вопрос о необходимости выполнения лимфаденэктомии. Большинство исследователей считает, что частота наличия микрометастазов в неувеличенных тазовых и паховых лимфатических узлах крайне низка. В связи с этим профилактическая лимфодиссекция, как правило, не применяется.
3.2.1 Лечение рака дистального отдела уретры
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
3.2.2 Лечение рака бульбо-мембранозного и простатического отдела уретры
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
При отсутствии противопоказаний к назначению цисплатина:
Уровень убедительности рекомендаций –В (уровень достоверности доказательств –3)
Уровень убедительности рекомендаций –С (уровень достоверности доказательств –4)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций –В (уровень достоверности доказательств –2)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
При отсутствии противопоказаний к назначению цисплатина:
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: хирургическое вмешательство выполняется через 4-6 недель после завершения неоаъювантной химиотерапии. Объем операции определяется индивидуально и может заключаться в выполнении экстирпации полового члена, цистостомии; эмаскуляции, цистостомии; экстирпации полового члена, простатэктомии, цистостомии; цистпростатэктомии с уретрэктомией и деривацией мочи по Брикеру.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: в настоящее время остается открытым вопрос о необходимости выполнения лимфаденэктомии. Большинство исследователей считают, что частота наличия микрометастазов в неувеличенных тазовых и паховых лимфатических узлах крайне низка. В связи с этим профилактическая лимфодиссекция, как правило, не применяется.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
При отсутствии противопоказаний к назначению цисплатина:
Уровень убедительности рекомендаций – В (уровень достоверности доказательств –3)
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
При отсутствии противопоказаний к назначению цисплатина:
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: стандартов 2-й линии лекарственной терапии не существует. При необходимости назначения 2-й и последующих линий лекарственной противоопухолевой терапии решение принимается индивидуально [17, 20, 29].
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов, страдающих раком уретры с хроническим болевым синдромом, соответствуют принципам обезболивания, изложенным в клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (коллектив авторов: Владимирова Л.Ю., Гладков О.А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. DOI: 10.18027/2224-5057-2018-8-3s2-502-511, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-35.pdf).
Принципы лечения и профилактики костных осложнений у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., Семиглазова Т.Ю. DOI: 10.18027/2224-5057-2018-8-3s2-512-520, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М. DOI: 10.18 027/2224-5057-2018-8-3s2-521-530, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. DOI: 10.18027/2224-5057-2018-8-3s2-531-544, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-38.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов раком с уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А. DOI: 10.18027/2224-5057-2018-8-3s2-545-563, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-39.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов c раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В. DOI: 10.18027/2224-5057-2018-8-3s2-564-574, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf).
Принципы нутритивной поддержки у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10.18027/2224-5057-2018-8-3s2-575-583, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов c раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. DOI: 10.18027/2224-5057-2018-8-3s2-591-603, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-44.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком уретры соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10.18027/2224-5057-2018-8-3s2-604-609, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-45.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов c раком уретры соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (автор: Буйденок Ю.В. DOI: 10.18027/2224-5057-2018-8-3s2-610-616, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf).
К настоящему времени не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть раком уретры или на риск рецидива или прогрессирования этого заболевания у пациентов с уже установленным диагнозом.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с раком уретры. Данные рекомендации сделаны на основании того, что во многих исследований, в том числе метаанализах (D. Steffens и соавт., 2018) и систематических обзорах (L. Nicole, N.L. Stout и соавт., 2017 и R. Segal и соавт., 2017.), доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: предреабилитация значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкоурологических патологий [56]. Предоперационная тренировка мышц тазового дна сокращает частоту развития недержания мочи в послеоперационном периоде [58].
4.2.1 Первый этап реабилитации
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
4.2.2 Второй этап реабилитации
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
4.2.3 Третий этап реабилитации
Уровень убедительности рекомендаций – A (уровень достоверности доказательств –1)
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1)
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Эффективной профилактики рака уретры не существует.
Основной целью наблюдения является максимально раннее выявление местных рецидивов и прогрессирования рака уретры, так как это обеспечивает возможность эффективного лечения.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: алгоритм обследования определяется лечащим врачом в зависимости от клинической ситуации.
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении на рак уретры или выявлении его у пациента врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи – врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам со злокачественной опухолью мочеиспускательного канала.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации рака уретры, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении на рак уретры или выявлении его в ходе оказания скорой медицинской помощи пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями мочеиспускательного канала, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями мочеиспускательного канала, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями мочеиспускательного канала в медицинской организации, оказывающей медицинскую помощь пациентам с раком уретры, не должен превышать 14 календарных дней с даты гистологической верификации рака уретры или даты установления предварительного диагноза рака уретры (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями мочеиспускательного канала, имеющих лицензию, необходимую материально-техническую базу и сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение рака уретры, которые требуют использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями мочеиспускательного канала, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
Показанием для госпитализации в медицинскую организацию в плановой форме является:
Показанием к выписке пациента из медицинской организации является:
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или после предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Пятилетняя выживаемость пациентов, страдающих раком уретры, составляет 35–40%. Мужчины живут несколько дольше, чем женщины: 5-летняя выживаемость в группах составляет 42 и 32% соответственно.
Наиболее существенным фактором, влияющим на продолжительность жизни, является стадия заболевания. Безрецидивная выживаемость в течение 42,1 мес при стадиях T1–2N0M0 составляет 89 %, при стадиях T3–4N0–2M0 – 42 % (р = 0,03). Пятилетняя выживаемость женщин, страдающих раком уретры T1–2N0 стадий, существенно выше, чем в группе пациенток с опухолями T3–4N0–2 стадий: 78 и 22 % соответственно. Для мужчин аналогичные показатели составляют 83 и 36 % соответственно.
Достоверным неблагоприятным фактором прогноза при раке уретры является поражение лимфатических узлов.
Опухоль дистального отдела уретры характеризуется, как правило, более высокой степенью дифференцировки, менее агрессивным ростом, низкой стадией. При расположении новообразования в проксимальной части мочеиспускательного канала отмечается более низкая степень дифференцировки, чаще наблюдается инвазивный рост с распространением процесса на соседние ткани и органы. Поэтому существенное влияние на прогноз оказывает локализация опухоли. Так, у мужчин специфическая 5-летняя выживаемость при поражении дистального отдела уретры составляет 40 %, тогда как при раке бульбомембранозного отдела – лишь 5 %. У женщин аналогичные показатели составляют 50 и 10–20 % соответственно.
На выживаемость пациентов с раком уретры существенно влияет вид лечения. По данным большинства исследователей, применение только хирургического вмешательства в большинстве случаев ассоциировано с плохим прогнозом. Так, 5-летняя выживаемость женщин после передней экзентерации таза, используемой как самостоятельный метод лечения, составляет 10–17 %, а частота местных рецидивов достигает 67 %. Пятилетняя выживаемость мужчин с опухолями висячего отдела уретры составляет 40 %, а при локализации процесса в бульбомембранозной части мочеиспускательного канала – 0 %.
Результаты лучевой терапии, применяемой в монорежиме при раке уретры, согласно данным литературы, остаются неудовлетворительными. Пяти- и 10-летняя выживаемость женщин, получавших только лучевую терапию, составляет 41 и 31 % соответственно, а частота местных рецидивов, развившихся в течение 5 лет, – 64 %.
Проведено сравнение результатов лечения 42 женщин, 10 из которых были только оперированы, а 32 получали в монорежиме лучевую терапию. Выживаемость в группах была одинакова, однако частота рецидивов после облучения была меньше, чем у пациентов после хирургического вмешательства: 40 и 64 % соответственно.
Увеличить выживаемость пациентов с раком уретры и уменьшить частоту рецидивов по сравнению с применением только хирургического метода или облучения в монорежиме позволяет комбинированное лечение. Длительная специфическая выживаемость пациентов с раком мочеиспускательного канала T3–4N0–2M0 стадий после комбинированного лечения, включавшего неоадъювантную химиолучевую терапию с последующим хирургическим вмешательством, составляет 60 %.
Выживаемость мужчин после только лучевой терапии и последующего хирургического вмешательства по поводу местного рецидива существенно меньше, чем в группе пациентов, получавших первичное комбинированное лечение (лучевая терапия и оперативное вмешательство).
Неоадъювантное облучение не влияет на выживаемость женщин, страдающих раком уретры, а лишь снижает частоту местных рецидивов. Пятилетняя безрецидивная выживаемость пациенток, перенесших облучение с последующим хирургическим вмешательством, составляет 55 %, что существенно больше, чем в группе пациентов, получавших только лучевую терапию (34 %).
В последнее время появились обнадеживающие данные, касающиеся применения при раке уретры химиолучевой терапии. Имеются сообщения о полном эффекте комбинированного химиолучевого лечения плоскоклеточного рака уретры с метастазами в регионарные лимфатические узлы. Описан случай полного эффекта неоадъювантной химиолучевой терапии при инвазивном раке висячей части мочеиспускательного канала с последующей резекцией дистального отдела уретры. Эффективность химиолучевой терапии подтверждает публикация, представляющая описание 54-летнего пациента с первичной аденокарциномой уретры с метастазами в паховые лимфатические узлы и головку полового члена. Авторы успешно провели 2 курса химиотерапии #фторурацилом** и #цисплатином** в сочетании с дистанционным облучением, добившись у пациента полной клинической ремиссии.
При многофакторном анализе данных 72 женщин наиболее важными признаками, влияющими на выживаемость при раке уретры, оказались стадия Т, состояние регионарных лимфатических узлов и локализация опухоли. По данным регрессионного анализа, наиболее значимые неблагоприятные признаки у мужчин – наличие регионарных метастазов, плоскоклеточный рак и локализация опухоли в проксимальной части уретры.
Таким образом, рак уретры является редкой опухолью, чаще встречающейся у женщин постменопаузального возраста и крайне редко развивающейся у мужчин. Наиболее характерной гистологической формой является плоскоклеточный рак. Клинические проявления данного новообразования неспецифичны, и значительная часть пациентов поступают в специализированные стационары с запущенными стадиями заболевания. Низкая частота рака уретры обусловливает отсутствие стандартного подхода к лечению этой категории пациентов. Органосохраняющее лучевое лечение в монорежиме в большинстве случаев ассоциировано с высокой частотой рецидивов и низкой выживаемостью. Применение только хирургического метода также недостаточно эффективно. В последнее время наилучшие результаты получены после применения комбинированного лечения, включающего неоадъювантную химиолучевую терапию с последующим хирургическим вмешательством. Профилактическая лимфаденэктомия не приводит к увеличению продолжительности жизни. Пятилетняя выживаемость пациентов с раком уретры составляет 35–40 %. Значимыми факторами прогноза являются стадия заболевания, локализация, размеры и гистологическое строение опухоли, состояние регионарных лимфатических узлов. Целью дальнейших исследований будет являться определение критериев дифференцированного отбора пациентов для определенных видов лечения с учетом прогностических признаков.
| № п/п | Критерий качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств | |
| 1 | Проведено физикальное обследование, включающее осмотр и пальпацию полового члена у мужчин, осмотр и пальпацию наружного отверстия уретры и стенок влагалища у женщин, а также промежности и зон регионарного метастазирования (паховые области) | С | 4 | |
| 2 | Проведена уретроцистоскопия при подозрении на опухоль мочеиспускательного канала | С | 4 | |
| 3 | Проведена МРТ малого таза | С | 4 | |
| 4 | Выполнено патологоанатомическое исследование биопсийного материала.до начала лечения | А | 1 | |
| 5 | Установлена стадия заболевания в соответствии с действующими классификациями TNM и Всемирной организации здравоохранения | А | 1 | |
| 6 | Выполнено хирургическое вмешательство пациенту с раком уретры, соответствующее стадии заболевания, в объеме, предусмотренном рекомендациями | А | 1 | |
| 7 | Проведена системная химиотерапия пациенту с местно-распространенным или диссеминированным раком уретры согласно клиническим рекомендациям | А | 1 | |
| 9 | Проведена лучевая терапия пациенту с местно-распространенным раком уретры | А | 1 | |
| 10 | Выполнено патологоанатомическое исследование удаленной опухоли в соответствии с рекомендациями, включая оценку состояния краев резекции при выполнении органосохраняющего лечения и степени лекарственного патоморфоза в случае проведения неоадъювантной лекарственной терапии | А | 1 | |
| 11 | Проведена оценка гематологической и негематологической токсичности в процессе лекарственной терапии | А | 1 |
Блок по медицинской реабилитации:
Кончугова Татьяна Венедиктовна – Врач-физиотерапевт, Заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» МЗ РФ, д.м.н., профессор
Обухова Ольга Аркадьевна – Врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ РФ, член европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания (RESPEN), к.м.н.
Семиглазова Татьяна Юрьевна – доктор медицинских наук, доцент, заведующий отделом – ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России,
Степанова Александра Михайловна – Заместитель директора по науке, заведующий отделением реабилитации Частный многопрофильный диагностический и реабилитационный центр «Восстановление»
Филоненко Елена Вячеславовна – Заведующий центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П. А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог, д.м.н., профессор
Блок по организации медицинской помощи:
Конфликта интересов нет.
Целевая аудитория данных клинических рекомендаций:
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных, анализ современных научных разработок по проблеме рака уретры в РФ и за рубежом, обобщение практического опыта российских и зарубежных специалистов.
Таблица 1. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| Уровень убедительности рекомендаций | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций. Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Данные клинические рекомендации разработаны с учетом следующих нормативно- правовых документов:
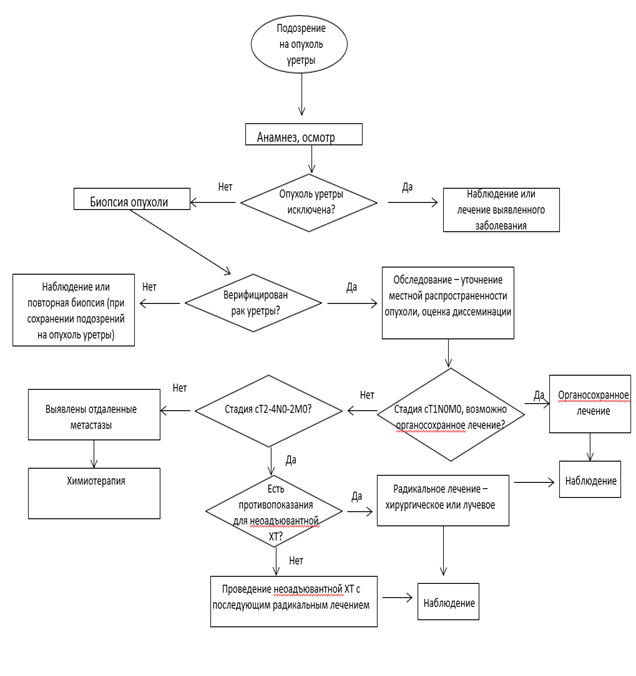
Пациента информируют о клинической картине и методах диагностики/стадирования рака уретры, знакомят с различными методами лечения и их потенциальными результатами/осложнениями. Выбирать метод лечения следует в результате такого собеседования после того, как пациент получил возможность задать все интересующие его вопросы.
Необходимо убедить пациента не стыдиться болезни и ознакомиться с научно-популярной литературой о раке уретры.
Следует информировать пациента о характере последующего наблюдения после лечения рака уретры, о важности регулярного обследования.
Самостоятельный контроль течения заболевания со стороны пациента невозможен, частота посещения врача определяется в индивидуальном порядке в каждом конкретном случае.
Рекомендации при осложнениях химиотерапии – связаться с врачом-онкологом (специалистом по химиотерапии).
При повышении температуры тела до 38 °C и выше – начать прием антибиотиков по назначению врача-онколога (специалиста по химиотерапии).
При стоматите:
При диарее:
При тошноте – принимать препараты по назначению врача-онколога (специалиста по химиотерапии).