Гены BReast Cancer 1 (BRCA1) и BReast Cancer 2 (BRCA2) называют генами «Анжелины Джоли». Распространенность мутаций в этих генах невысокая (около 1 % в общей популяции), но их пенетрантность (то есть риск развития рака молочной железы у носителей BRCA1 или мутаций BRCA2) достигает 70–80 %. И поэтому при пересчете в фокус-группах частота встречаемости онкогенных мутаций в этих генах меняется:
- примерно 6 % у всех больных раком молочной железы;
- около 10 % среди тех, у кого рак молочной железы развивается до 40 лет;
- может достигать 20 % у женщин с семейным анамнезом РМЖ.
Мутации в генах BRCA1/2 не являются самостоятельной причиной онкологического заболевания, но их наличие сопряжено и с повышенным риском развития РПЖ, более молодым возрастом манифестации заболевания и более агрессивным его течением.
Для BRCA-ассоциированного РПЖ эксперты выделяют следующие характерные особенности:
- более высокая сумма баллов по шкале Глисона ≥8;
- склонность к формированию отдаленных метастазов;
- снижение выживаемости на фоне стандартной терапии РПЖ.
При наличии мутаций в генах BRCA1\2 риск развития РПЖ увеличивается в 2–6 раз, при этом риск РПЖ до 65 лет увеличивается почти в 9 раз при наличии мутации в BRCA2. В соответствии с этим EAU рекомендует мужчинам с наличием мутаций в BRCA2 начинать скрининг по ПСА гораздо раньше – с 40 лет (в то время как для остальных мужчин возрастным порогом остается черта 50 лет). В обновленной версии рекомендаций EAU также отмечено, что мутации в BRCA2 могут считаться независимым фактором плохого прогноза при локализованном заболевании.
Аналогичные утверждения и рекомендации (с той или иной вариабельностью) даны всеми мировыми профессиональными ассоциациями, в компетенции которых входит мониторинг и лечение пациентов с РПЖ. EAU, NCCN, AUA/ASTRO/SUO и ESMO подчеркивают необходимость проводить генетическое тестирование мужчинам с семейной историей ЗНО вообще, а также при наличии среди кровных родственников смерти от РПЖ в молодом возрасте или наследственных форм РМЖ и РЯ среди женщин кровного родства первого порядка.
Скрининг по BRCA
В работе, представленной уфимцами на Секции молодых ученых (ежегодный конгресс РООУ-2021), сделано все то, что рекомендовано мировым экспертным сообществом. Исследователи разработали тончайшую персонифицированную программу скрининга для здоровых мужчин, имеющих подтвержденные генетические мутации.
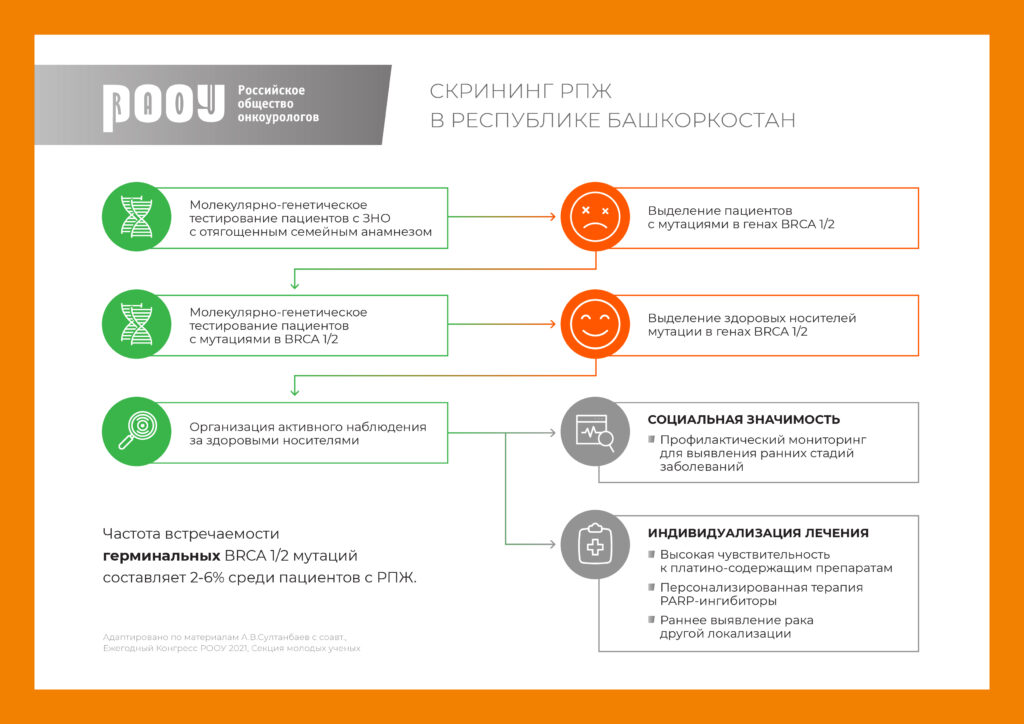
В исследование вошли здоровые родственники пациентов, у которых ранее была определена мутация в генах BRCA 1/2. «Всего у 130 пациентов с ЗНО различных локализаций были обнаружены мутации в генах BRCA; родственники 30 пробандов дали согласие на генетическое исследование и прошли консультацию генетика с дальнейшим выявлением носителей герминальных мутаций», – рассказывает А. В. Султанбаев.
В скрининговое исследование вошли 50 кровных родственников пробандов старше 35 лет, у которых методом Сэнгера определялась мутация, характерная для пробанда. У 22 из 50 здоровых родственников пациентов были выявлены мутации в генах BRCA 1/2, в том числе у 10 мужчин. С учетом возраста манифестации рака в семье специалисты организовали персональные профилактические мероприятия по ранней диагностике РПЖ. «В результате диагностики за 2020 год у 2 из 22 здоровых носителей мутации гена BRCA 1/2 в возрасте 52 и 58 лет на I стадии выявлен РПЖ», – говорит А. В. Султанбаев.
«В России большее внимание уделяется пациентам с установленным диагнозом, – подчеркнул А. В. Султанбаев. – Программы по скринингу РМЖ, РЯ, РПЖ в клинической практике могли бы быть более интенсивными и персонифицированными». По словам ученого, в РФ имеется явная диспропорция в обеспечении и внимании к профилактическим мерам, в то время как профилактика не должна быть менее значимой, чем оказание помощи уже заболевшим.
Помимо BRCA1/2 для прецизионного скрининга могут иметь значение и другие гены HRR: BARD1, CHEK1, PALB2, RAD51C, BRIP1, CHEK2, PPP2R2A, RAD51D, ATM, CDK12, FANCL, RAD51B, RAD54L. Однако проводить столь масштабное тестирование исключительно дорого. «Тестирование стоит проводить с учетом территориальных/национальных особенностей встречаемости для конкретного региона мутаций, однако имея в виду, что в любом регионе могут встречаться редкие мутации», – отмечает ученый. А. В. Султанбаев обращает внимание, что для пациентов с отрицательными результатами тестирования, но имеющими наследственный характер развития ЗНО необходимо применять более широкую панель для тестирования методом NGS.
IMPACT
В настоящее время программы скрининга герминальных мутаций в здоровой популяции не имеют должной популярности. «С носителями герминальных мутаций необходимо разрабатывать персонифицированные программы по скринингу ЗНО», – объясняет А. В. Султанбаев. И внимательный читатель обратит внимание, что описанный масштаб работы (и затрат!) привел к выявлению рака всего у двух пациентов.
В настоящее время предложенная схема скрининга не принята мировым сообществом и системой здравоохранения и является локальной инициативой. Однако в исследовании IMPACT (Identification of Men with a Genetic Predisposition to ProstAte Cancer: Targeted screening in BRCA1/2 mutation carriers and control) как раз предусмотрено проведение скрининга в популяции носителей мутаций в BRCA1/2 и аналогичная схема скрининга апробируется на когорте более чем 3000 человек.
Промежуточные результаты IMPACT опубликованы в European Urology в 2019 году: «Наличие мутации BRCA1\2 увеличивает риск раннего развития РПЖ и наличия агрессивных характеристик опухоли», – сказано в работе. Эти предварительные выводы сделаны по данным 3-летнего скрининга, проведенного 527 мужчинам, среди которых были как мужчины с мутациями в BRCA1\2, так и без них. Всего же в протокол включено около 3000 мужчин, которые проходят генетическое тестирование и в течение трех лет находятся под наблюдением врачей, в случае увеличения ПСА до 3 нг/мл мужчинам предлагается пройти биопсию.
Заболеваемость РПЖ на 1000 человеко-лет оказалась выше в группе носителей мутаций в BRCA2 (19,4 vs 12.0; p = 0,03), пациенты с мутациями чаще имели клинически значимый РПЖ (77 % vs 40 %; p = 0,01). Кроме того, отмечено, что маркер 4K оказался более точным в предсказании выявления клинически значимого РПЖ во время биопсии (area under the curve [AUC] = 0,73) в сравнении с ПСА (AUC = 0,65).
Авторы исследования отмечают, что уже сейчас можно уверенно говорить о необходимости более раннего и детализированного скрининга пациентов с мутациями HRR.
Порядок и формы организации скрининга среди выделенной группы пациентов остаются предметом исследования и дискуссии. Тем не менее очевидна необходимость более персонифицированного подхода к данной группе пациентов.
РООУ выражает благодарность исследователям и врачам, локально организовавшим скрининг столь высокой точности и персонифицированности. Желаем научному коллективу успехов и ожидаем более зрелых данных на ежегодном Конгрессе РООУ-2022.
В статье упомянуты следующие данные:
- Page, E. C. et al. Interim results from the IMPACT study: evidence for prostate-specific antigen screening in BRCA2 mutation carriers. Eur. Urol. https://doi.org/10.1016/j.eururo.2019.08.019 (2019)
- Taylor, R. A. et al. The influence of BRCA2 mutation on localized prostate cancer. Nat. Rev. Urol. 16, 281–290 (2019) HYPERLINK “https://dx.doi.org/10.18632%2Foncotarget
23.11.2021



