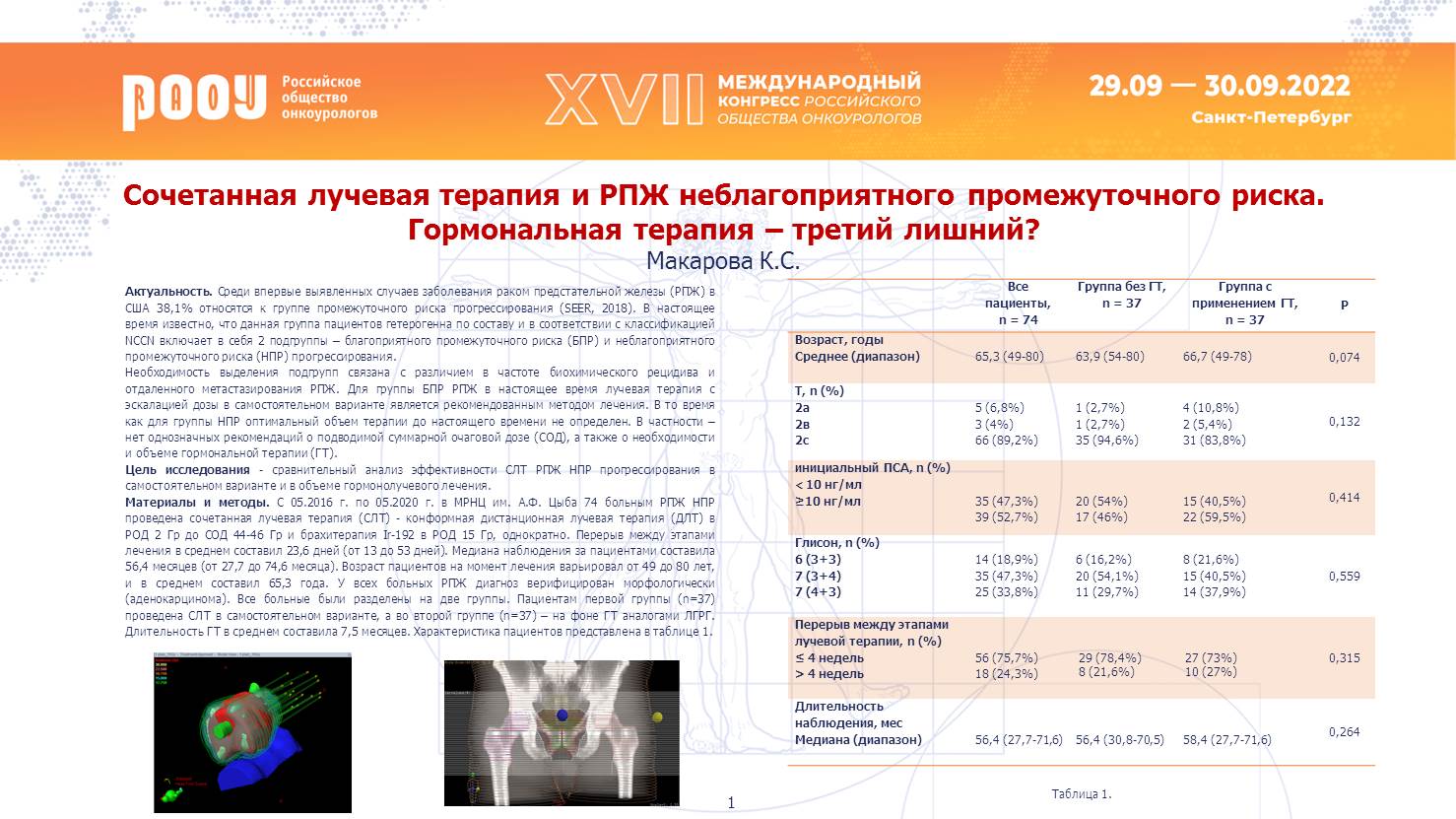
Пациенты с РПЖ промежуточного прогноза могут иметь благоприятный и неблагоприятный риск – такая внутригрупповая стратификация произошла на основании данных эпидемиологических исследований, и стратификация внутри системы стратификации уже оказывает влияние на стратегию лечения пациента.
В МРНЦ им. А. Ф. Цыба сочетанная лучевая терапия применяется с 2016 года. Обобщенные результат по 74 пациентам, получившим в дополнение к дистанционной лучевой терапии еще высокомощностную брахитерапию (Ir-192 в РОД 15Гр, однократно) доступны в постере автора.
– Каково соотношение пользы и рисков за счет увеличения лучевой нагрузки?
– Да, соотношение эффективности и безопасности – это краеугольный камень лучевой терапии, как, впрочем, и любого лечения. Достаточное количество крупных исследований подтвердило повышение локального контроля и выживаемости без биохимического рецидива при эскалации суммарной очаговой дозы (СОД) до 79 Гр при проведении дистанционной лучевой терапии (ДЛТ) рака предстательной железы (РПЖ) [1, 2, 3]. Но какой ценой? Так, по данным группы исследователей из Онкологического центра им. М. Д. Андерсона, опубликованным в 2008 году, за период наблюдения 10 лет эскалация СОД до 78 Гр приводила к двукратному повышению частоты поздних осложнений ³2 степени со стороны желудочно-кишечного тракта (ЖКТ) в сравнении с ДЛТ в СОД 70 Гр – 26 % и 13 % соответственно (p = 0,013) [3]. А в исследовании RTOG 0126 5-летняя кумулятивная частота поздних лучевых повреждений ³2 степени со стороны мочевыводящих путей (МВП) составила 7 % в группе СОД 70,2 Гр и 12 % в группе СОД 79,2 Гр (р = 0,003) [4]. Такая закономерность развития поздних осложнений ДЛТ диктовала необходимость поиска новых технологий эскалации дозы излучения непосредственно в опухоли.
Накопленные данные о радиобиологических особенностях клеток РПЖ и успешное применение брахитерапии (БТ) в качестве монотерапии РПЖ благоприятного прогноза позволили рассмотреть применение БТ как дополнение к ДЛТ – интерес к БТ в качестве буста неуклонно возрастал. Например, с 2006 по 2017 год применение буста БТ в Канаде возрастало на 24 % ежегодно (OR:1,24, 95 % CI 1,22–1,26, p < 0,01) [5]. Высокий градиент дозы излучения позволил уменьшить нагрузку на органы риска, в особенности на прямую кишку [6].
Технологические достижения сделали лучевую терапию более прецизионной. И сегодня стереотаксическая лучевая терапия (СТЛТ) является одним из наиболее динамично развивающихся методов лучевого лечения РПЖ. Предварительные результаты демонстрируют высокую эффективность СЛТ с применением буста СТЛТ у больных высокого риска прогрессирования РПЖ – четырехлетние показатели выживаемости без биохимического прогрессирования заболевания достигают 92–94 % [7]. Однако сведения о безопасности лечения разноречивы, что, вероятно, сопряжено с различием в подходах к реализации СТЛТ, режимах фракционирования, применяемых в различных центрах. Безусловно, требуется более длительное наблюдение для оценки соотношения эффективности и токсичности данного вида лечения.
– Как вы выбираете способ эскалации локальной дозы?
– Единого мнения относительно показаний к тому или иному виду БТ в качестве буста до настоящего времени нет. В большей степени это связано с отсутствием рандомизированных исследований, посвященных их сравнению. Большинство имеющихся данных (по нерандомизированным исследованиям) демонстрируют равную эффективность буста низкомощностной брахитерапии (НМБТ) и высокомощностной брахитерапии (ВМБТ). Например, сравнительный анализ общей выживаемости 18 403 больных РПЖ при проведении СЛТ и ВМБТ/НМБТ в качестве буста при медиане наблюдения 5 лет продемонстрировал равную эффективность методик (AHR 1,03 [0,96, 1,11]; p = 0,38) [8]. А в 2021 году группа авторов из Испании представила результаты сравнительного анализа эффективности и токсичности СЛТ РПЖ промежуточного риска прогрессирования с применением в качестве буста ВМБТ в одной группе пациентов, а в другой группе – НМБТ. При медиане наблюдения 66,5 месяца выживаемость без биохимического прогрессирования составила 92 % и 94 % для групп ВМБТ и НМБТ соответственно (р = 0,615). Статистически значимых различий в частоте клинически значимых поздних осложнений отмечено не было [9]. В то же время, по данным исследования Matthew G. Parry с соавт., опубликованного в 2021 году, при наблюдении в среднем 4,6 года, поздние осложнения 2-й степени со стороны ЖКТ наблюдали почти в два раза чаще при проведении буста НМБТ (32,3 %), в сравнении с бустом ВМБТ – 16,7 %. Различий в частоте осложнений со стороны МВП не отмечено [10].
В отношении буста СТЛТ, как уже отмечено выше, предварительные результаты демонстрируют высокую эффективность данного метода лечения. Однако следует иметь в виду, что 100 % предписанной дозы на мишень также получает и вся простатическая часть уретры. И, по данным единственного проспективного многоцентрового исследования 2-й фазы PROMETHEUS при проведении буста СТЛТ с СОД 19-20 Гр за 2 фракции, кумулятивная частота поздних осложнений ³2 степени со стороны МВП составила 27,1 % (длительность наблюдения – 36 месяцев) [11]. Методики уретросберегающей СТЛТ в настоящее время только исследуются, и еще рано говорить о результатах.
Таким образом, каждая методика локальной эскалации дозы имеет свои особенности и, ввиду отсутствия рандомизированных проспективных исследований сравнительной эффективности и безопасности их применения, решение следует принимать в соответствии с технической оснащенностью центра, программным обеспечением и клиническим опытом специалистов.
– Могут ли данные патоморфологического исследования повлиять на тактику ЛТ?
– Как известно, 95 % всех злокачественных опухолей предстательной железы составляет ацинарная аденокарцинома. Американский объединенный комитет по изучению рака выделяет 6 редких гистологических подтипов аденокарциномы предстательной железы, среди которых наиболее распространенной является протоковая карцинома [12]. Однако для данной группы пациентов предпочтительно хирургическое лечение, которое способствует повышению общей выживаемости [13]. Встречаемость других подтипов настолько редка, что проведение исследований по тактике лечения, в том числе лучевой терапии, практически неосуществимо.
Вместе с тем ацинарная аденокарцинома также гетерогенна по составу, и стратификация больных по группам риска прогрессирования РПЖ основывается, в числе прочего, на степени дифференцировки опухоли. И для разных групп риска объем и метод лучевой терапии отличаются. Так, для группы низкого и благоприятного промежуточного риска прогрессирования РПЖ в настоящее время БТ или ДЛТ с эскалацией дозы в самостоятельном варианте являются рекомендованным методом лечения [14, 15], в то время как для группы неблагоприятного промежуточного и высокого риска предпочтительно применение комбинации БТ, ДЛТ и гормональной терапии. Хотя стоит заметить, что оптимальный объем терапии все же до настоящего времени не определен. В частности, нет однозначных рекомендаций о подводимой СОД, а также об объеме гормональной терапии.
Приглашаем посмотреть видеозапись выступления и ответов на вопросы, заданные в зале.
В ответах на вопросы автор ссылается на следующие источники:
- David P Dearnaley, Gordana Jovic, Isabel Syndikus et al. Escalated-dose versus control-dose conformal radiotherapy for prostate cancer: long-term results from the MRC RT01 randomised controlled trial. Lancet Oncol. 2014, Apr;15(4):464-73. doi: 10.1016/S1470-2045(14)70040-3.
- Wilma D Heemsbergen, Abrahim Al-Mamgani, Annerie Slot et al. Long-term results of the Dutch randomized prostate cancer trial: impact of dose-escalation on local, biochemical, clinical failure, and survival. Radiother Oncol. 2014 Jan;110(1):104-9. doi: 10.1016/j.radonc.2013.09.026.
- Deborah A Kuban, Susan L Tucker, Lei Dong et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys. 2008 Jan 1;70(1):67-74. doi: 10.1016/j.ijrobp.2007.06.054.
- Jeff M Michalski, Jennifer Moughan, James Purdy et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncol. 2018 Jun 14;4(6):e180039. doi: 10.1001/jamaoncol.2018.0039.
- Mark T Corkum, Gerard Morton, Alexander V Louie et al. Is prostate brachytherapy a dying art? Trends and variation in the definitive management of prostate cancer in Ontario, Canada. Radiother Oncol. 2020 Nov;152:42-48. doi: 10.1016/j.radonc.2020.07.036.
- Nicholas G Zaorsky, Laura A Doyle, Kosj Yamoah et al. High dose rate brachytherapy boost for prostate cancer: a systematic review. Cancer Treat Rev. 2014 Apr;40(3):414-25. doi: 10.1016/j.ctrv.2013.10.006.
- Aruz Mesci, Naghmeh Isfahanian, Ian Dayes et al. The Journey of Radiotherapy Dose Escalation in High Risk Prostate Cancer; Conventional Dose Escalation to Stereotactic Body Radiotherapy (SBRT) Boost Treatments. Clin Genitourin Cancer. 2022 Feb;20(1):e25-e38. doi: 10.1016/j.clgc.2021.09.004.
- Martin T King, David D Yang, Vinayak Muralidhar et al. A comparative analysis of overall survival between high-dose-rate and low-dose-rate brachytherapy boosts for unfavorable-risk prostate cancer. Brachytherapy. 2019 Mar-Apr;18(2):186-191. doi: 10.1016/j.brachy.2018.12.007.
- Silvia Rodríguez Villalba, Paula Monasor Denia, Maria Jose Pérez-Calatayud et al. Low-/high-dose-rate brachytherapy boost in patients with intermediate-risk prostate cancer treated with radiotherapy: long-term results from a single institution team experience. J Contemp Brachytherapy. 2021 Apr;13(2):135-144. doi: 10.5114/jcb.2021.105280.
- Matthew G Parry, Julie Nossiter, Arunan Sujenthiran et al. Impact of High-Dose-Rate and Low-Dose-Rate Brachytherapy Boost on Toxicity, Functional and Cancer Outcomes in Patients Receiving External Beam Radiation Therapy for Prostate Cancer: A National Population-Based Study. Int J Radiat Oncol Biol Phys. 2021 Apr 1;109(5):1219-1229. doi: 10.1016/j.ijrobp.2020.11.023.
- G Peyraga, T Lizee, J Khalifa et al. Brachytherapy boost (BT-boost) or stereotactic body radiation therapy boost (SBRT-boost) for high-risk prostate cancer (HR-PCa). Cancer Radiother. 2021 Jun;25(4):400-409. doi: 10.1016/j.canrad.2020.11.004.
- Chandler Bronkema, Sohrab Arora, Akshay Sood et al. Rare Histological Variants of Prostate Adenocarcinoma: A National Cancer Database Analysis. J Urol. 2020 Aug;204(2):260-266. doi: 10.1097/JU.0000000000001011.
- Chandler Bronkema, Sohrab Arora, Jacob Keeley et al. Impact of treatment modality on overall survival in localized ductal prostate adenocarcinoma: A national cancer database analysis. Urol Oncol. 2021 Jun;39(6):366.e11-366.e18. doi: 10.1016/j.urolonc.2020.11.013.
- NCCN Clinical Practice Guidelines in Oncology. Prostate Cancer, Version 4.2022, https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
08.11.2022